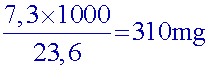TP
: chimie des eaux de consommation
1. Tester
différentes eaux
Objectif : Sur vos tables, se trouvent 4 verres en
plastique contenant chacun une eau différente (eau du robinet, eau
distillée,
eau minérale de Volvic, eau de Contrex) : par étude de leurs
propriétés, vous
devez identifier quelle eau se trouve dans chaque bécher…
Vous pouvez vous aider pour cela :
de
différents tests chimiques ou….gustatifs !
des
étiquettes donnant la composition des deux eaux
minérales.

Composition Minéralogique (mg/L)
| Ca2+ |
467 |

|
| Mg2+ |
84 |
| Na+ |
7 |
| HCO3-
|
377 |
| SO42-
|
1192 |
| Cl- |
7 |
| Résidu sec |
2032 |
1.1
Test
gustatif :
Pour déterminer la saveur d'une eau, on peut s'aider
de quelques termes utilisés par les dégustateurs d'eau :
Saveur acide
Saveur magnésienne (salée
et amère)
Saveur chlorée
Saveur
amère
Saveur
sodée
Saveur de
vase
Saveur
sucrée Saveur
métallique
Saveur bicarbonatée
Goûter chaque eau (verser un peu d’eau dans un gobelet en plastique)
pour mettre en évidence leurs différences….Remplir le tableau §1.6
1.1
Test
du pH
Pour avoir une valeur approchée du pH d'une eau, déposer, à l’aide de
l’agitateur, une goutte d'eau sur un petit morceau de papier pH, et
lire sur l'échelle de teinte la valeur du pH.
Rincer l’agitateur avec de l’eau distillée et recommencer avec une autre variété d’eau.
Remplir le tableau §1.6
1.2
Test
des ions calcium
Pour détecter la présence d’ion calcium, on utilise de
l'oxalate d'ammonium. Si l’eau contient des ions calcium, on observe un
précipité blanc.
Mode
opératoire : Verser 1mL d’eau dans un tube à
essais. Ajouter 2 gouttes d’oxalate d’ammonium.
Faire le test pour chacune des eaux et remplir le
tableau.
1.3
Test
des ions chlorures
Pour détecter la présence d’ion chlorure, on utilise du
nitrate d’argent. Si l’eau contient des ions chlorures, on observe un
précipité
blanc.
Mode
opératoire : Verser 1mL d’eau dans un tube à
essais. Ajouter 2 gouttes de nitrate d’argent.
Faire le test pour chacune des eaux et remplir le
tableau.
1.4
Dureté
d’une eau
Une eau est dite dure quand elle contient une
forte proportion d'ions calcium (Ca2+) et d’ion
magnésium (Mg2+).
Cela se traduit par une eau qui mousse difficilement en
présence de savon.
Préparer quatre tubes à essai remplis au quart avec
les eaux à tester.
Ajouter 3 gouttes de liqueur de savon dans chacun des
tubes. Agiter les tubes en les frappant , doucement, une dizaine de
fois.
Constater s’il y a ou non beaucoup de mousse. L’indiquer
sur la ligne du tableau avec les symboles + ou -.
1.6 Conclusion
Attribuez à chaque bécher l'eau qu'il contient :
(justifier)
| Bécher (ou verre) n° |
A |
B |
C |
D |
| Test du pH |
7
|
7
|
5,9
|
6
|
| Test des ions calcium |
/
|
/
|
un peu de Ca2+
|
Beaucoup de Ca2+
|
| Test des ions chlorures |
présence de Cl-
|
/
|
présence de Cl-
|
présence de Cl- |
| Test de la dureté |
-
|
-
|
+
|
+
|
| Test gustatif |
gout peu prononcé
|
fade
|
|
Gout métallique
|
| Identification de l’eau |
Volvic |
Eau distillée |
Eau du robinet |
Contrexéville |
2. Dosage des ions hydogénocarbonate dans une eau
Le but du dosage est la détermination de la concentration
en ions hydrogénocarbonate HCO3-
de l’eau d'Evian. Cette concentration
en mg/L sera
comparée à l’indication de l’étiquette.
remarque : les ions
hydrogénocarbonate sont encore appelés ions bicarbonates
2.1
Tests
préliminaires
Test préliminaire : (BCR : vert de
bromocrésol-rhodamine)
couleur du BCR dans une solution d’acide
chlorhydrique : orange
couleur du BCR dans une solution d’ions
hydrogénocarbonate : bleu
2.2
Mode
opératoire :
On dispose de trois solutions :
une
solution A de concentration connue en ions
hydrogénocarbonate : 730 mg/L
une
solution B : un échantillon d’eau minérale d’Evian
une
solution diluée d’acide chlorhydrique (C = 0,01
mol.L-1)
Placer 10 mL (prélevés à l’aide d’une pipette) de
solution d’acide chlorhydrique dans un bécher et ajouter quelques
gouttes de BCR.
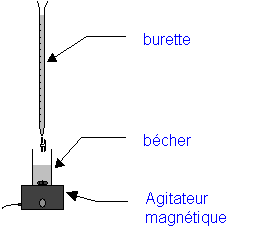 Remplir la burette avec la solution de référence A,
ajuster le niveau au zéro.
Remplir la burette avec la solution de référence A,
ajuster le niveau au zéro.
En homogénéisant le mélange à l’aide de l’agitateur
magnétique, faire couler doucement la solution A dans le bécher
jusqu’au changement
de couleur de l’indicateur coloré.
Va = 10,1 mL
Après avoir rincé la burette à l’eau distillée,
recommencer la manipulation en remplaçant la solution A par l’eau
minérale B.
Vb
= 23,6 mL
2.3
Exploitation
des résultats :
Dans 1L de (A) il y a 730 mg d’ion hydrogénocarbonate.
Dans 1mL de (A) il y a 0,73 mg d’ion hydrogénocarbonate
Dans Va=10,1mL de (A) il y a 10,1 ×0,73 = 7,3 mg d’ion
hydrogénocarbonate
Les ions hydrogénocarbonate ont réagi avec la même
quantité d’acide chlorhydrique.
Dans Vb=23,6 mL d'eau d'Evian (B), il y a donc 7,3 mg d’ion
hydrogénocarbonate
Dans 1 L(=1000 mL) d'eau d'Evian, il y a donc: 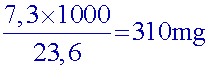
La concentration d’ion hydrogénocarbonate de la solution (B)
est de : 310mg/L
Sur l’étiquette, il y a indiqué : 360 mg/L
Conclusion :
La valeur trouvée est proche de la valeur indiquée par l'étiquette. La différence provient d'erreurs expérimentales.





 Remplir la burette avec la solution de référence A,
ajuster le niveau au zéro.
Remplir la burette avec la solution de référence A,
ajuster le niveau au zéro.