La chimie dans la maison
1. La chimie dans la casserole
1.1
Recette de mayonnaise
Ingrédients :
- 1 jaune d’œuf
- ¼ de litre d’huile
- 1 cuillère à café de moutarde
- 1 cuillère à café de jus de citron ou de vinaigre
- sel, poivre
Mettre dans un bol, le jaune d’œuf, saler, poivrer et bien
mélanger au fouet.
Ajouter le jus de citron, mêler. Incorporer l’huile,
en un
mince filet, en fouettant énergiquement.
1.2 Quelle est la composition du jaune
d’œuf ?
Expérience 1 prof :
Sur un
peu de jaune d’œuf on effectue le test au sulfate de cuivre anhydre.
Observations:
Le sulfate de
cuivre anhydre, initialement blanc, prend une coloration bleue.
Conclusion:
Le jaune d’œuf est essentiellement composé d’eau mais il
contient également
des
protéines et de
lipides.
Est-ce l’eau présente dans le jaune d’œuf qui permet de
réaliser une mayonnaise ?
1.3 Le mélange eau-huile
a) Expérience_2_élèves
Verser environ 1 mL
d’eau et 1 mL
d’huile dans un tube à
essais .
Observation:
L’huile
et
l’eau ne se mélangent pas. L’huile
reste au dessus de l’eau.
Conclusion:
L’huile
et
l’eau ne sont pas miscibles,
on dit
que deux phases se forment.
Mélanger
énergiquement. Observer. Laisser reposer quelques instants. Observer.
Observation: Des gouttes
d’huile semblent se mélanger à
l’eau. Au bout de quelques instants, les deux phases se séparent de
nouveau.
Conclusion: Quand on mélange eau et huile en
secouant vigoureusement, quelques
gouttes
d’eau entrent dans l’huile et quelques gouttes d’huile vont dans l’eau
: on
obtient une émulsion.
Mais en laissant reposer les gouttelettes d’huile se
rassemblent à nouveau, les deux phases se séparent : l’émulsion est
instable
une
émulsion est une
dispersion en fines gouttelettes d’un liquide non miscible avec un
autre.
Exemples :
la crème fraiche est une émulsion
d’huile dispersée dans l’eau
Le
beurre est une émulsion d’eau dispersée dans
l’huile
b)
Interprétation
b .1
La molécule d’eau
Quelle est la structure de la
molécule
d’eau ?
Les trois atomes (O, H et H) forment
un triangle.)
La molécule est électriquement
neutre, mais les différents atomes qui la constituent portent des
petites
charges électriques:
on dit qu’elle est
polaire.
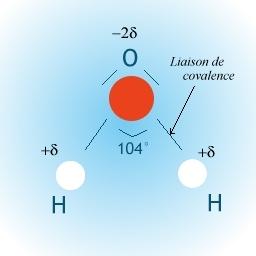
Que peut-il se produire entre l’atome
d’oxygène d’une molécule d’eau et
l’un des atomes d’hydrogène d’une autre molécule d’eau ?
L’atome d’oxygène étant légèrement
chargé négativement, il va attirer
un atome
d’hydrogène (chargé positivement) d’une autre molécule : cela
va former
une liaison hydrogène
.

De façon générale, un liquide,
dont les molécules peuvent former des liaisons hydrogène avec les
molécules
d’eau, se mélange
à l’eau de façon homogène.
b.2
Quelle
est la structure de la molécule d’huile ?
L’huile est un corps gras
ou lipide.
C’est une molécule essentiellement constituée d’atomes de carbone et
d’hydrogène (chaîne carbonée) et qui a la forme d’un peigne à trois
dents.
Ci-dessous, la molécule
d’oléine, principal
composant de l’huile d’olive.

L’huile n’est pas une molécule
polaire ; elle ne peut pas de former des liaisons hydrogène
avec l’eau
donc ces deux liquides ne sont pas miscibles.
b.3 Conclusion
L’huile et l’eau du jaune
d’œuf sont-ils les
seuls constituants de base
de la mayonnaise ?
L’huile et l’eau contenue dans le
jaune d’œuf ne sont pas les seuls constituants de base de la mayonnaise
car le
mélange huile et eau ne donne pas une émulsion stable.
Un autre constituant de l’œuf doit
intervenir.
Comme seul le jaune est utilisé
pour réaliser une mayonnaise, c’est un des lipides du jaune d’œuf qui
intervient.(Si les protéines intervenaient,
on utiliserait également le blanc de l’œuf.)
1.4 La stabilisation de l’émulsion
a) Le
jaune
d’œuf
Expérience_2_
élève
Dans un tube à essais,
mettre un peu de jaune d’œuf et un peu d’huile, mélanger.
Observation:
L’huile et le
jaune d’œuf se
mélangent.
Dans un tube à essais,
mettre un peu de jaune d’œuf et un peu d’eau, mélanger.
Observation:
L’eau et le
jaune d’œuf se
mélangent.
Conclusion: Le jaune d’œuf
contient des molécules qui
se
mélangent avec l’eau et
avec l’huile, ces molécules sont
dites
tensioactives.
b) Les molécules tension actives

Schématisation d’un composé
tensioactif:

La
tête est
« hydrophile » (= qui
aime l’eau):
elle peut former des liaisons
hydrogène.
Queue « hydrophobe » (= qui
n’aiment pas l’eau), mais
« lipophile » (= qui
aime les
graisses) : elle est constituée d'une longue chaîne carbonée.
Dans le jaune d’œuf, c’est la lécithine
( lipide) qui est le
composé tensio-actif
On trouve également des
molécules tensioactives dans la
moutarde…
c) Que se passe-t-il lors de la réalisation de la
mayonnaise ?
Lorsqu’on mélange l’huile et le
jaune d’œuf, on mélange en réalité de l’huile, de l’eau et de
la
lécithine.
Lorsqu’on fouette le mélange, les
molécules tensioactives de lécithine enrobent les
gouttelettes d’huile,
en
mettant à leur contact leur partie lipophile : il
se forme
des micelles.
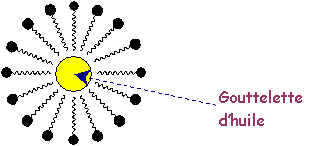
Les
têtes hydrophiles sont toutes chargées
positivement ; les
micelles se repoussent et se dispersent dans l’eau . Elles forment des
liaisons
hydrogène avec les molécules d’eau ce qui assure la
stabilité
de la
mayonnaise.

La
mayonnaise est donc une émulsion stable entre l’huile
et l’eau du
jaune d’œuf.
1.5 Comment réussir une mayonnaise ?
a) Expérience _4 _élèves:
|
|
1
|
2
|
3
|
4
|
Expériences |
On mélange doucement
du jaune
d’œuf et de l’huile que l’on ajoute goutte
à goutte
|
On mélange énergiquement
du
jaune d’œuf et de l’huile que l’on ajoute goutte à goutte
|
On mélange énergiquement
du
jaune d’œuf et de l’huile que l’on ajoute en une seule fois
|
On mélange énergiquement
de la
moutarde, du vinaigre et de l’huile ajoutée goutte à goutte
|
Résultats
|
La mayonnaise prend difficilement
|
La mayonnaise est jaune et
épaisse
|
La mayonnaise est ratée
|
La mayonnaise est plus
fluide et plus blanche
|
b) Conclusions
Pourquoi faut-il ajouter l'huile
goutte à goutte?
On ajoute progressivement
l’huile à la phase aqueuse
(et non l’inverse), car il faut diviser
l’huile en gouttelettes
microscopiques,
ce qui est bien plus facile si l’on part d’une goutte d’huile dans
l’eau
qu’inversement.
Mayonnaise vue au microscope à différents stades de la préparation:



site :
http://pedagogie.ac-montpellier.fr:8080/disciplines/scphysiques/SP2.htm
Quelle est l'influence
de la vitesse de mixage?
Plus la
vitesse de mélange est grande, plus la
mayonnaise est dure.
En effet, plus l’huile est
divisée en fines gouttelettes et plus les micelles seront petites, ce
qui
augmente la compacité donc la dureté de la mayonnaise.
Quelle est l'influence de la
température?
De même,
si un des constituants est à une température très basse, il sera plus
difficile
de fragmenter l’huile en gouttelettes, la mayonnaise ne sera pas
réussie.
Pour
réussir une mayonnaise, il faut que ses constituants soient à la
température
ambiante.
Et si on ajoute de la moutarde, du jus
de citron?
La moutarde contient aussi des
molécules
tensioactives, elle joue le même rôle que le jaune d’œuf...et en plus,
elle
améliore le goût !
Si on ajoute du jus de citron, on apporte davantage d’eau à l’émulsion
déjà
constituée : les gouttelettes d’huile ont davantage de
place et l’émulsion
est stabilisée.
(Ces gouttelettes ont aussi plus de place pour s’écouler,
elles ne se gênent donc plus : la viscosité diminue, la
mayonnaise est
plus fluide.)
Super cours en pdf accessible par
ac nancy metz
2. Le
savon
2.1
Structure et mode d’action des savons
(
DVD :
« C’est pas SORCIER : la grande lessive »)
a) Le savon est un tensioactif
Les particules
de
savon sont des molécules tensioactives
; elles présentent deux
extrémités :
une extrémité hydrophile
(qui a beaucoup
d’affinité pour l’eau) et une extrémité lipophile
(ayant des
affinités pour
les graisses) mais hydrophobe.
b) Le savon dans l'eau
Quand on met du savon dans l'eau,
ces
particules ont tendance à se placer à l’interface
eau/air :
les têtes hydrophiles
vers l’intérieur.
les
extrémités lipophiles
orientées vers
l’extérieur. 
Dans
l'eau,
les
particules de savon se regroupent: les parties hydrophobes qui fuient
l'eau
se rassemblent entre elles, on obtient alors des micelles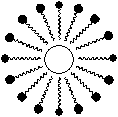
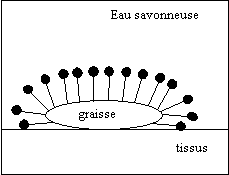
c) Comment un savon lave-t-il ?
Le savon,
grâce à
ses deux extrémités , va s'immiscer entre le tissu et la
saleté. et détruit ainsi son adhérence. En
présence de graisses (constituant la
saleté), les particules savonneuses peuvent s'enfoncer dans les taches
d'huile , les enfermer à l’intérieur de micelles grâce à leur partie lipophiles ,
les retirer du tissu et les disperser dans l’eau grâce
à leur extrémité. Le savon a un pouvoir émulsifiant.
 |
 |
 |
| La queue
hydrophobe des molécules de
détergent se fixe dans la graisse. |
Les têtes
hydrophiles se repoussent
entre elles, provoquant une agglomération de la tache. |
Une agitation
modérée décolle la
tache de graisse du tissu. Les micelles ainsi formées se dispersent
dans l’eau. |
d) Pourquoi est-ce que l’eau savonneuse mousse si
on la remue ?
Quand
on agite de l’eau savonneuse, on fait s’y dissoudre de l’air. Les
bulles d’air
s’échappent ensuite du liquide en entraînant avec elles un film d’eau
savonneuse, se qui forme des bulles.
On
parle du pouvoir
moussant .
Remarque :
Le
meilleur détergent
n’est pas obligatoirement le produit qui mousse le plus.
2.2
La tension
superficielle
a)
qu'est-ce que la tension superficielle?
Dans le
liquide, les molécules d’eau au centre
sont
attirées par toutes leurs voisines, dans toutes les directions, donc
ces
attractions se compensent.
Si
on considère une molécule située à la surface
d’un liquide  ,
elle est soumise à des forces d’attraction de la part des molécules
voisines
qui l’empêchent de quitter
le liquide (sauf par
évaporation).
,
elle est soumise à des forces d’attraction de la part des molécules
voisines
qui l’empêchent de quitter
le liquide (sauf par
évaporation).
Nous pouvons donc considérer la
surface d’un liquide comme une membrane élastique
tendue.
La surface de l’eau
est donc soumise à une force qui l’attire vers l’intérieur du
liquide :
c’est la force de tension
superficielle .
On peut la mettre en évidence en posant délicatement une épingle sur la
surface de l'eau : elle flotte
( comme certains insectes..)
b ) Action du savon sur la tension superficielle
Si on verse un peu d'eau savonneuse, l'épingle coule
immédiatement.
Le savon empêche les molécules d’eau de se
regrouper
entre elles, il
diminue la
tension superficielle.
Le savon permet ainsi à l’eau de mieux
pénétrer dans les petites interstices entre les fibres des tissus ou de
s’étaler correctement sur les surfaces. On dit que le savon augmente
« le
pouvoir mouillant de l’eau ».
Remarque : le savon perd son
efficacité si l’eau est
calcaire
( riche en ion magnesium Mg2+
et en ion calcium
Ca2+
) ; il mousse
moins.
On utilise alors
des anticalcaires
pour
neutraliser le
calcaire.
2.3 Les détergents
Un
détergent est un produit qui nettoie en entraînant les impuretés.
Le savon est le plus ancien détergent.
D’autres
détergents,
utilisés pour le nettoyage de la vaisselle, du linge, de l’entretien
ménager …
sont fabriqués mais ces détergents synthétiques, qu’ils soient à usage
domestique ou industriel, sont tous des
composés
tensioactifs.
Le savon est
biodégradable mais ce n’était pas le cas pour les premiers détergents
synthétiques d’où la formation de mousses polluantes.
Depuis 1970,
seuls sont
autorisés les détergents dont les composés tensioactifs sont
biodégradables à
plus de 90%.
3. La biodégradabilité d'un produit ménager
Document
1 : Les
matériaux
biodégradables
La
technologie,
l'utilisation et le marché des matériaux biodégradables sont en plein
développement. Pare-chocs de voiture, couche-culotte pour bébé ou carte
de
crédit, trouvera-t-on demain du biodégradable partout ?
« En Suède, une
chaîne
de restauration rapide propose à ses clients des couverts
biodégradables à base
d'amidon de maïs. En Angleterre, une banque a remplacé le PVC de ses
cartes de
paiement par un polyester biodégradable obtenu à partir de sucre de blé
ou de
betterave. Coup de pub ou réelle tendance du marché ? Les
matériaux
biodégradables vont-ils devenir d'usage courant ?Un matériau
est dit
biodégradable s'il a la capacité d'être dégradé par des
micro-organismes tels
que les bactéries, les champignons et les algues. Le résultat final de
cette
dégradation doit être de l’eau, du dioxyde de carbone ou du méthane.
Les
matériaux naturels issus de végétaux tels que le bois, le liège, le lin
ou le
coton sont biodégradables. « Ils sont connus depuis des
millénaires. Mais
nous constatons réellement un engouement pour ces produits depuis
quelques
années », souligne Louis Wallaert, directeur de la société
Batichanvre,
une entreprise grenobloise qui fabrique des briques de chanvre pour la
construction. Le côté « naturel à faible impact sur
l'environnement »
séduit, il est vrai, de plus en plus le consommateur. La nouveauté est
que l'on
commence à trouver ces matières dans des usages inhabituels. La paille
compressée ou le maïs broyé servent d'isolant dans les habitations. Des
couverts jetables à base de son compacté sont sur le point d'être
commercialisés. Des garnitures internes de portière de voitures
existent
maintenant en fibre de lin ou de sisal et les constructeurs automobiles
envisagent même de faire des pare-chocs en fibres végétales consolidées
par une
résine biodégradable.
Même le
plastique
devient écolo.....
Mais
les matériaux biodégradables ne se limitent pas aux seuls produits
naturels.
Les matières plastiques deviennent elles aussi biodégradables. Alors
qu'il faut
parfois plusieurs centaines d'années pour dégrader un plastique
ordinaire,
quelques mois suffisent à ces nouveaux matériaux pour être réduits en
eau et
dioxyde de carbone au contact de micro‑organismes. Leur origine est
synthétique ou à base de ressources végétales. La plupart des grands
chimistes
industriels en proposent maintenant dans leur gamme de plastiques.
Ainsi,
vous pouvez trouver des boites de rillettes en Polynat. Cette matière
distribuée par le Français Roverc'h est issue de la gélification
d’amidon de
farine de seigle, plastifiée à l'aide d'alcools naturels. L'Éco-Pla,
commercialisé par la firme américaine Cargill Dow Polymers est purement
synthétique. Il est obtenu à partir de polymères (des macromolécules)
de
synthèse, les polyesters aliphatiques. On en fait des films agricoles
ou des
pots de yaourt. D'autres produits combinent polymères de synthèse et
matières
naturelles. Le Mater-Bi fabriqué depuis près de sept ans par l'Italien
Novamont
associe l'amidon du maïs à des polymères synthétiques (les
poly-epsilon-caprolactones). Ses applications vont des couches-culottes
aux
sacs de supermarché, en passant par les coton-tige ou les assiettes
jetables.
Malgré
des utilisations et des technologies en pleine évolution, les
plastiques
biodégradables sont cependant encore très marginaux. La production
mondiale
annuelle est actuellement de 14 000 tonnes, soit moins de
0,02 % de celle
des plastiques ordinaires. Leur coût élevé reste leur principal
handicap :
ils sont de 1,3 à 10 fois plus chers. Et leurs propriétés mécaniques
n'égalent
pas encore celles de leurs concurrents. Alors ces matériaux ont-ils
réellement
un avenir ? « Oui », affirme Véronique
Bellon-Maurel, directrice
de recherche au Cemagref et membre du comité français pour la
biodégradabilité.
« Les réglementations antipollution vont pousser les
industriels à
développer ces produits. À partir de 2002, les décharges ne pourront
plus
recueillir les déchets plastiques usagés. Une des solutions pourrait
donc être
de produire de la matière qui se dégrade comme des végétaux. »
Qu’est ce qu’un matériau
biodégradable ?
un matériau biodégradable peut être
dégradé par des
micro-organismes tels
que les bactéries, les champignons et les algues....
En quoi doit-il se transformer?
En eau, dioxyde de carbone ou
méthane. ( molécules plus petites )
Quelles sont les sources possibles de
matériaux
biodégradables ?
Matériaux naturels (maïs, pommes de
terre, coton, chanvre, seigle...)
Définir succinctement le terme de
« polymère ». Citer quelques exemples.
Ce sont des molécules géantes
("macromolécules").
Le nylon, le polystyrène, le PVC....sont des polymères.
Remarque : il existe des polymères naturels : la cellulose, l'amidon ...
Pourquoi les matières plastiques biodégradables ne sont
pas encore très utilisés ?
Leur coût est encore très élevé..
Document
2 : La
biodégradation
Une biodégradation complète
se déroule en trois phases :
1/ Biofragmentation.
Les micro-organismes, aidés par
d’autres facteurs
comme la chaleur, les contraintes mécaniques (déchirures, poinçonnages,
élongations...) ou le rayonnement ultraviolet, attaquent le matériau.
Ils le
cassent en composés plus petits, microfragments ou grosses molécules.
2/
BioassimilationLes
composés sont ensuite
absorbés par les
micro-organismes.
3/
Minéralisation.
Les composés assimilés sont enfin
« minéralisés », ils sont transformés par les
micro-organismes en eau
et en dioxyde de carbone s'il y a présence d'oxygène (conditions
aérobies) ou
en eau et en méthane sans présence d'oxygène (conditions anaérobies).
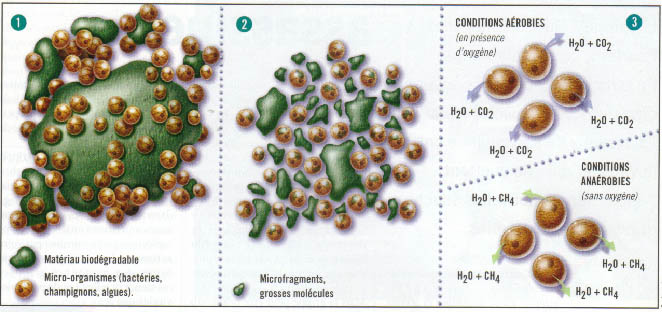
d’après
un article paru dans le magazine Euréka de janvier 2000
Quels sont les facteurs qui favorisent
la
biofragmentation ?
La chaleur, les contraintes mécaniques,
la lumière.
Qu’appelle-t-on microorganismes ? Citez quelques
exemples.
Bactéries, champignons, plantes
microscopiques....
Document
3 : Bio-emballages
pour
produits contemporains
Bio-films en
polymères naturels, emballages
comestibles... De nouvelles technologies, écologiques autant
qu'économiques,
permettent d'accroître la sécurité et la qualité des aliments "prêts à
l'emploi."
Légumes
prêts à l'emploi, plats précuisinés, aliments réfrigérés emballés sous
vide et
autres innovations dont le bénéfice principal est sans doute le gain de
temps
et de préparation connaissent un succès grandissant. Ils intéressent
les
consommateurs et la restauration collective. Ils laissent aux
industriels une
marge bénéficiaire non négligeable et ont connu ces derniers temps une
croissance annuelle de l'ordre de 10 à 15%. Le succès de ces denrées
s'explique
aisément. Celles-ci sont parfaitement assimilables à des produits frais
- la
faible transformation qu'elles ont subie n'altère ni leur aspect ni
leur
qualité. Elles offrent une facilité d'emploi parfaitement
"contemporaine" (portions divisibles, réchauffement au four à
micro-ondes, etc.). Leur fraîcheur est garantie par une date de
péremption.
Mais encore...
Polymères
naturels
La
sécurité et la qualité de ces produits périssables impliquent la
prévention de
la croissance des micro-organismes pathogènes (comme les bactéries ou
les
champignons) et du développement des agents responsables du
défraîchissement
naturel et du pourrissement. Traditionnellement assurées par des
barrières de
type thermique (conservation à basse température), biologique
(traitements désinfectants
ou antibiotiques) et physique (emballages), les techniques de
protection et de
préservation des aliments s'améliorent constamment.
Un
projet de recherche mené dans le cadre du programme AIR entre 1993 et
1997 (AIR
0125) a ainsi permis de mettre au point un nouveau concept de
bio-emballage,
dans lequel les couches protectrices (constituées traditionnellement de
films
plastique issus de polymères synthétiques) sont produites à partir de
polymères
naturels, provenant de plantes. Cette innovation présente d'importants
atouts.
L'aptitude des bio-emballages à modifier les échanges gazeux les rend
particulièrement intéressants pour le traitement des fruits et des
légumes
frais, qui conservent un métabolisme actif lors de leur conservation à
basse
température et doivent continuer à "respirer". Les antimicrobiens et
antioxydants utilisés pour protéger les aliments peuvent en outre,
grâce à ce
système "bio", être introduits dans l'emballage même et préserver
davantage le caractère naturel des produits. Le bio-emballage
est en outre une solution économique (les matières premières entrant
dans la
fabrication de bio-films sont peu coûteuses) et écologique
(biodégradables, les
emballages à base de polymères naturels réduisent le volume des déchets
industriels et ménagers).
Rechercher les informations par
Google
www.alyon.org
dans sciences et techniques, chimie, principales matières plastiques.
www.domsweb.org
dans écologie, plastiques
biodégradables.
www.agrisalon.com

















 ,
elle est soumise à des forces d’attraction de la part des molécules
voisines
qui l’empêchent de quitter
le liquide (sauf par
évaporation).
,
elle est soumise à des forces d’attraction de la part des molécules
voisines
qui l’empêchent de quitter
le liquide (sauf par
évaporation).

