Oxydant : ion permanganate MnO4-(aq)
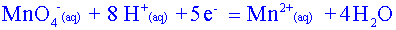
Objectif : Déterminer la concentration exacte dune solution S0 deau oxygénée du laboratoire.
Données.
|
Espèce chimique étudiée |
Peroxyde d'hydrogène ou eau oxygénée |
Ions permanganate |
Solutions de diiode |
|
Formule |
H2O2(aq) |
MnO4-(aq) |
I2(aq) |
|
Couples rédox |
H2O2(aq) / H2O O2(g) / H2O2(aq) |
MnO4-(aq) / Mn2+(aq) |
I2(aq) / I-(aq) |
|
Caractéristiques |
Les solutions de permanganate de potassium sont violettes ; les ions Mn2+ (aq) (manganèse) sont incolores |
Les solutions de diiode sont brunes à jaune selon leur concentration. Les ions I-(aq) (ions iodure) sont incolores |
solution de permanganate de potassium( K+(aq)+MnO4-(aq)) sur la solution deau oxygénée en milieu acide
Dans un tube à essais, verser environ
1 mL de solution deau oxygénée
diluée S1 + 2 mL environ
de solution dacide
sulfurique (2H+(aq)+ SO42-(aq)) ;
ajouter goutte à goutte environ
1 mL de solution de permanganate de potassium.
Puis ajouter un
excès de cette même solution de permanganate de
potassium.
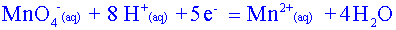
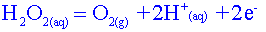
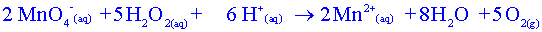
solution diodure de potassium ( K+(aq) + I-(aq) ) sur la solution de H2O2, en milieu acide
Dans un tube à essais, verser environ 2 mL de solution deau oxygénée diluée S1 + 2 mL environ de solution dacide sulfurique. Ajouter environ 0,5 mL de solution d'iodure de potassium.
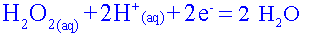
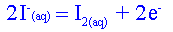
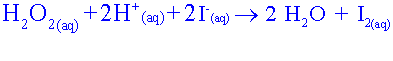
Etablir le tableau davancement de la réaction choisie. Quelle est la relation entre les quantités de matière à l'équivalence ?
 |
||||||
| E. initial | n2versé | n1i | / | 0 | / | 0 |
| en cours | n2versé - 2x | n1i - 5x | / | 2x | / | 5x |
| A l'équivalence | n2versé - 2xE | n1i - 5xE | / | 2xE | / | 5xE |
A l'équivalence, on
a : n2versé - 2xE =
0 et n1i
- 5xE
= 0
Donc :  (relation 1)
(relation 1)
Placer
un peu de solution S1 dans un bécher
(propre et rincé auparavant avec un peu de S1).
Prélever, à
l'aide d'une pipette jaugée (rincée au
préalable avec un peu de S1), un
volume V = 10,0 mL de la solution diluée S1,
le placer dans un erlenmeyer (propre et sec).
·
Ajouter 20 mL d'eau distillée et
10 mL d'acide sulfurique à 1 mol.L-1
(volumes prélevés avec une éprouvette
graduée).
·
Préparer la burette :
vérifier le bon fonctionnement du robinet, rincer la burette
avec un peu de la solution titrée de permanganate de
potassium (de concentration C2 = 2,00.10-2
mol.L-1 ), remplir la burette avec la
solution titrée et ajuster le zéro.
Verser la solution de permanganate de
potassium et noter le volume nécessaire pour que la
coloration rose persiste. Faire 2 dosages : un rapide et un
précis à la goutte près. Noter les
valeurs obtenues (Ve).
a) Faire un schéma annoté du dispositif de dosage : nom de la verrerie, des réactifs. Expliquer succinctement le choix de la verrerie et son utilisation correcte.
La solution S1 est prélevée à l'aide d'une pipette jaugée de 10,0 mL(précision).
La solution de permanganate est versée dans la burette que l'on a préalablement rincée avec cette même solution.
b) Quel est le rôle de l'acide sulfurique concentré ?
c) En utilisant la relation 1, donner la relation littérale entre C1 (concentration de la solution S1 en eau oxygénée), V1, C2 et VE. En déduire la valeur de la concentration de la solution S1.
n1i = C1 V1 et n2versé = c2 VE
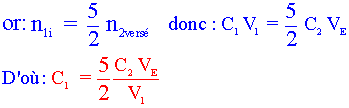
d) Calculer la concentration de la solution commerciale So d'eau oxygénée.