Ch 1.2 Spectrophotométrie
1.Objectifs
Connaître
la technique de spectrophotométrie.Montrer
qu’un spectrophotomètre donne une réponse en absorbance linéaire avec
la
concentration d’une espèce colorée.Utiliser
cette propriété pour le suivi temporel de la réaction d’oxydation des
ions
iodure par les ions peroxodisulfate.
2. Principe
de la spectrophotométrie
Une substance colorée
absorbe
certaines radiations du spectre visible.
(voir animations 1
et 2)
L’absorbance
A
caractérise l’absorption d’une radiation lumineuse par une substance X,
pour
une longueur d’onde l
donnée.
Soit F0
est le flux lumineux
incident et F
le flux transmis.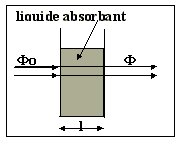
L’absorbance
est définie par
: 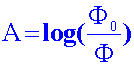
A est un
nombre sans
dimension.
Si la
substance est
totalement transparente : F
= F0
et A = 0
Si la
substance est
totalement opaque : F
= 0 et A → ∞
3.SPECTRES
D’ABSORPTION
3.1 Obtention de l'échelle de teintes
On veut réaliser
une échelle de teintes à partir de la solution mère de diiode de
concentration 5,00.10-3
mol.L-1.
Les volumes V de solution mère prélevés
à l’aide d’une
burette sont à déterminer sachant que le volume de la fiole jaugée
utilisée est
de 50 mL.
Verser
les différentes solutions dans des tubes à essai .
| [I2]
(mmol.L-1) |
2,00 |
1,60 |
1,40 |
1,20 |
1,00 |
0,800 |
0,600 |
0,400 |
0,200 |
0
blanc |
| V (mL) |
20,0
|
16,0 |
14,0 |
12,0 |
10,0 |
8,0 |
6,0 |
4,0 |
2,0 |
0 |
| A |
1,0 |
0,80 |
0,70 |
0,60 |
0,50 |
0,40 |
0,30 |
0,20 |
0,10 |
0 |
3.2 Conclusion
Établir
la relation entre l’absorbance A et
la concentration molaire en diiode [I2] présente
dans la solution.
Le graphe est une droite passant par
l'origine ; donc A est proportionnelle à [I2]
3.3 Loi
de Beer-Lambert :
Pour
des solutions de
substance X ( suffisamment diluées ), l’absorbance est proportionnelle
à la
concentration [X] :
A = el×
l ×
[X]= k × [X]
où
el
est le coefficient d’extinction molaire pour
la longueur d’onde
considérée.
l est la largeur de la cuve
Un
spectrophotomètre est un
appareil qui mesure l'absorbance A de la solution contenue dans une
cuve
de dimension imposée, pour une longueur d'onde donnée.
En pratique, on
utilise
une radiation qui correspond à un maximum
d’absorption
pour la
substance
donnée.
Détermination de k : On prend un point de la droite éloigné de
l'origine:
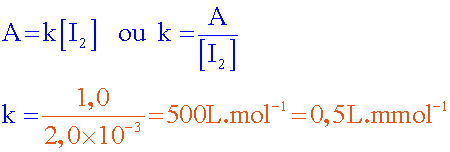
4. Suivi
spectrophotométrique d’une réaction
On
étudie la réaction entre les ions iodure I-
( couple ( I2 / I -
) et les ions péroxodisulfate S2O82-
(S2O82-
/ SO42- ).
Pour
cette transformation en solution aqueuse, le
diiode est la seule espèce colorée. Sa formation au cours
du temps peut
être
suivie par spectrophotométrie et ainsi permettre d’effectuer un suivi
temporel
de la transformation.
4.1 Matériel
et produits
2
pipettes jaugées de 10 mL ; 2
béchers de 100 mL ; 1 chronomètre
Solution
d’iodure de potassium de concentration molaire 5,00 .10-1
mol.L-1.
Solution
de peroxodisulfate d’ammonium de concentration molaire 4,00.10-3
mol.L-1.
4.2 Manipulation :
Un groupe effectuera un
suivi au spectrophotomètre et communiquera les résultats aux autres.
Les autres effectueront un
suivi qualitatif à l’aide de leur échelle de teinte et relèveront les
valeurs
données par le spectrophotomètre.
4.3 Exploitation :
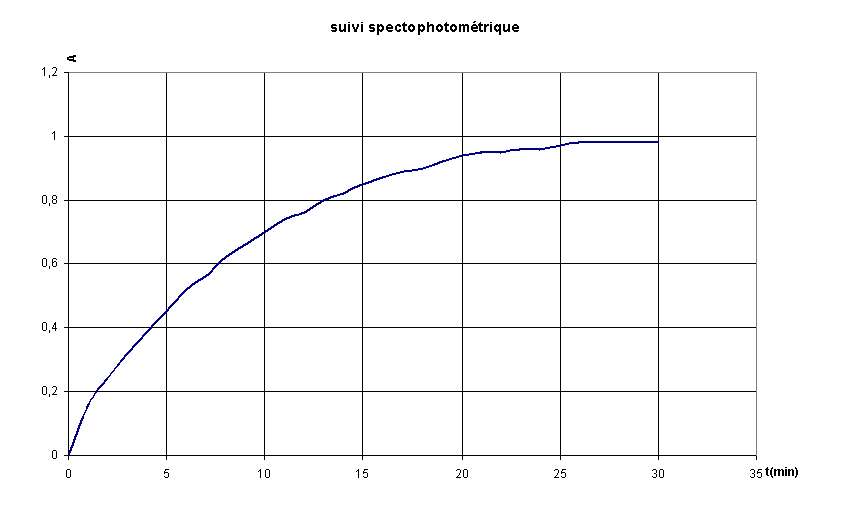
Montrer
comment la courbe [I2] = g (temps) se déduit de
la courbe A = f
(temps). Quelle sera son
allure ?
Donc 
Il
suffit de calculer en chauque point, la concentration....
La
courbe [I2] = g(t) aura la même forme
que la courbe A = f(t)
Ecrire
l'équation de la réaction asociée à la transformation étudiée
( couples S2O82-
/ SO42-
et I2 / I-).
2 I-
(aq)
= I2(aq)+ 2 e-
S2O82-(aq)
+ 2 e- = 2 SO42-(aq)
Donc : S2O82-(aq)
+ 2 I- (aq) =
2 SO42-(aq)
+ I2(aq)
Etablir le tableau d'avancement
quantité
de S2O82-(aq) versée
initialement :
C1× V1
= 4,00× 10-3× 10,0 × 10-3
= 4,00×
10-5
mol
quantité de I-(aq) versée
initialement : C2× V2
= 5,00× 10-1× 10,0 × 10-3=
5,00× 10-3 mol
|
S2O82-(aq)
+
2 I- (aq)
=
2 SO42-(aq)
+ I2(aq) |
| E. initial |
4,00×
10-5 |
5,00× 10-3 |
0 |
0 |
| en cours |
4,00×
10-5 - x |
5,00× 10-3 -
2 x |
2 x |
x |
| E.final |
4,00×
10-5 - xmax |
5,00× 10-3 -
2 xmax |
2xmax |
xmax |
Définir
la vitesse volumique de la réaction , l’exprimer en fonction
de la
concentration molaire en diiode formé, puis
en
fonction de A.
De plus :
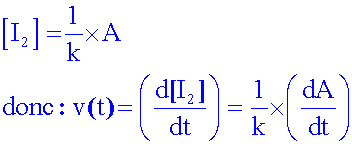
Déterminer
cette vitesse aux dates : t = 0 et t = 15 min ;
comment évolue la
vitesse de la réaction au cours du temps ?
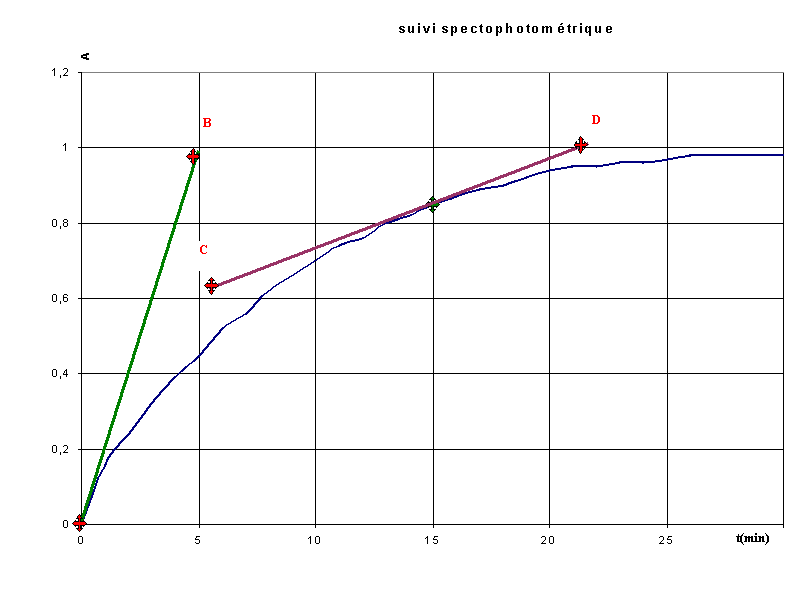
Pour déterminer 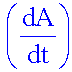 ,
on trace la tangente à la courbe A = f(t) à
la date considérée et on calcule le coeficient directeur.....( k = 0,5 L.mmol-1 )
,
on trace la tangente à la courbe A = f(t) à
la date considérée et on calcule le coeficient directeur.....( k = 0,5 L.mmol-1 )
A t=0: 
A t = 15min : 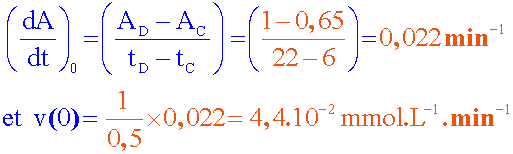
Déterminer
le temps de demi-réaction de cette réaction d’oxydation (totale)
effectuée à
20°C.
Si S
2O
82-(aq)
est le réactif limitant : 4,00×
10
-5 - x
max = 0 donc
xmax
= 4,00×
10
-5 mol
Si I
- (aq) est
le réactif limitant : 5,00× 10
-3 -
2
xmax = 0
donc
xmax
= 2,50×
10
-3 mol
Donc
xmax
= 4,00×
10
-5 mol = n
I2max
(car k = 0,5 L.mmol
-1 = 0,5.10
3
L.mol
-1 )

par lecture graphique, t
1/2 =
5,8 min
( ce qui signifie qu'au bout de 5×6 = 30 min, la réaction est
achevée...cela correspond bien au graphe!)


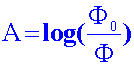
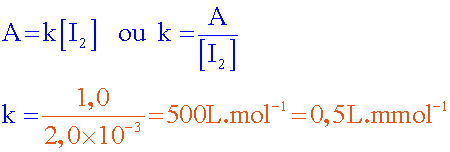


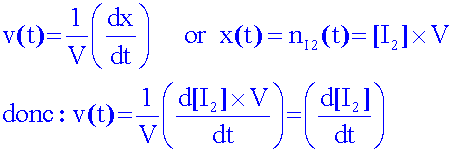
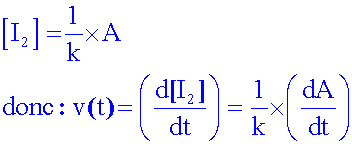

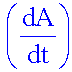 ,
on trace la tangente à la courbe A = f(t) à
la date considérée et on calcule le coeficient directeur.....( k = 0,5 L.mmol-1 )
,
on trace la tangente à la courbe A = f(t) à
la date considérée et on calcule le coeficient directeur.....( k = 0,5 L.mmol-1 )
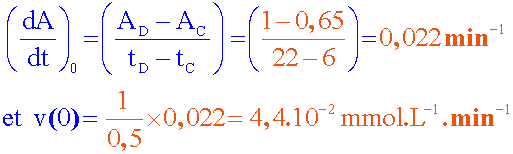

 par lecture graphique, t1/2 = 5,8 min
par lecture graphique, t1/2 = 5,8 min