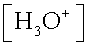 à la fin de la réaction
(noté
à la fin de la réaction
(noté 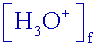 )
)a. Ecrire l’équation de la réaction de l’acide chlorhydrique avec l’eau.
HCl + H2O = H3O+ + Cl-
b. Calculer la quantité de matière initiale.
nHCL = c×V = 10-2 × 0,1 = 10-3 mol = 1 mmol
c. Compléter le tableau d’avancement :
| HCl + H2O = H3O+ + Cl- | |||||
| t =0 | x = 0 | 1 | / | 0 | 0 |
| t | x | 1 - x | / | x | x |
| t→ ∞ | xf | 1 - xf | / | xf | xf |
d. En déduire : xmax
Le réactif limitant est HCl ; donc xmax = 1 mmol
e. On mesure le pH de cette solution ; pH = 2.
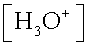 à la fin de la réaction
(noté
à la fin de la réaction
(noté 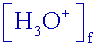 )
)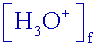 = 10-pH = 10-2
mol.L-1
= 10-pH = 10-2
mol.L-1
xf
= 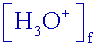 × V= 10-2 ×
0,1 = 10-3 mol = 1
mmol
× V= 10-2 ×
0,1 = 10-3 mol = 1
mmol
Tout l’acide chlorhydrique HCl a réagi avec l’eau
a. Ecrire l’équation de la réaction de l’acide éthanoïque avec l’eau.
CH3COOH + H2O = H3O+ + CH3COO-
b. Calculer la quantité de matière initiale.
nCH3COOH = c2×V = 10-2 × 0,1 = 10-3 mol = 1 mmol
c. Compléter le tableau d’avancement :
| CH3COOH + H2O = H3O+ + CH3COO- | |||||
| t =0 | x = 0 | 1 | / | 0 | 0 |
| t | x | 1 - x | / | x | x |
| t→ ∞ | xf | 1 - xf | / | xf | xf |
d. En déduire : xmax
Le réactif limitant est CH3COOH ; donc xmax = 1 mmol
e. On mesure le pH de cette solution ; pH = 3,4.
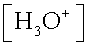 à la fin de la réaction
(noté
à la fin de la réaction
(noté 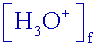 )
)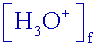 = 10-pH = 10-3,4
= 4.10-4mol.L-1
= 10-pH = 10-3,4
= 4.10-4mol.L-1
xf
= 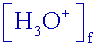 × V= 4.10-4 ×
0,1 = 4.10-5 mol =
0,04 mmol
× V= 4.10-4 ×
0,1 = 4.10-5 mol =
0,04 mmol
L’acide éthanoïque n’a pas entièrement réagi avec l’eau. ( seules 4% des molécules ont réagi...)