
Etude d’un équilibre chimique par conductimétrie
Objectifs.
Etudier
une réaction d’un acide avec l’eau.
Par
la conductimétrie, déterminer le taux
d’avancement final τ et le quotient de réaction à l’équilibre
Qr,éq.
Déterminer les facteurs dont dépendent ces grandeurs.
On dispose de V litres de solution aqueuse d'un acide HA de concentration molaire c. La réaction de cet acide HA sur l'eau n'est pas totale
Dresser un tableau d’évolution des espèces chimiques au cours de la transformation chimique de HA dans l’eau. On appellera x l’avancement de réaction et xf l’avancement final.
Ajouter une ligne au tableau en considérant la réaction comme totale. Dans cette hypothèse, exprimer l'avancement maximal xmax en fonction de c et V.
| HA(aq) + H2O = H3O+(aq)+ A-(aq) | |||||
| E. initial | x = 0 | c V | / | 0 | 0 |
| en cours | x | c V - x | / | x | x |
| E.final | xf | c V - xf | / | xf | xf |
| si la réaction est totale | xmax | c V - xmax | / | xmax | xmax |
Exprimer le taux d’avancement final τ (τ = xf/xmax en fonction de la concentration finale [H3O+]eq et de c.

Exprimer le quotient de réaction Qr,eq à l’équilibre, en fonction de [H3O+]eq et de c.


G = I / U G = σ × S / L σ =Σ( (λi x [ Xi ] ) Kcell = L / S
Plonger la cellule conductimétrique
dans une solution de
chlorure de potassium de concentration molaire connue
précisément
.
Mesurer précisément la température de
cette solution.
Etalonner la cellule selon le mode d’emploi.
Attention : L’appareil mesure directement la conductivité σ en mS.cm-1 ou µS.cm-1
Exprimer la conductivité σHA de la solution HA, en fonction des conductivités molaires ioniques λA- et λH3O+ des ions présents et de [ H3O+]eq.

En déduire [ H3O+]eq en fonction de σHA , de λA- et de λH3O+.
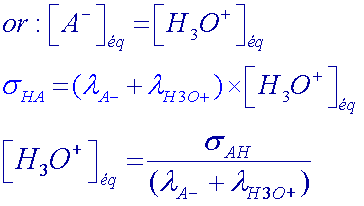
Acide éthanoïque
| C (mol.L-1) | σHA (S.m-1) | [H3O+]eq (mol.L-1) | τ (%) | Qr,eq |
| 1,00x10-3 | 5,08 × 10-3 | 1,3 × 10-4 | 13% | 1,9× 10-5 |
| 5,00x10-3 | 1,22 × 10-3 | 3,1 × 10-4 | 6,2% | 2,0× 10-5 |
| 10,00x10-3 | 1,76 × 10-3 | 4,5 × 10-4 | 4,5% | 2,0× 10-5 |
Acide benzoïque
| C (mol.L-1) | σHA (S.m-1) | [H3O+]eq (mol.L-1) | τ (%) | Qr,eq |
| 1,00x10-3 | 9,27 × 10-3 | 2,4 × 10-4 | 24% | 7,7× 10-5 |
| 5,00x10-3 | 2,16 × 10-2 | 5,6 × 10-4 | 11% | 7,2× 10-5 |
| 10,00x10-3 | 3,1 × 10-2 | 8,1 × 10-4 | 8% | 7,2× 10-5 |
Pour une réaction donnée, le taux d’avancement final τ dépend des conditions initiales ; comment varie τ lorsque la concentration initiale c diminue ? (ce qui revient à faire une dilution)
D'après les résultats, lorsque la concentration diminue, τ augmente ( = l'acide est plus dissocié lorsqu'il est dilué)
Pour une réaction chimique donnée et à température donnée, le quotient de réaction Qr,eq est une constante indépendante des conditions initiales. Vérifier que cette affirmation est vérifiée pour la réaction étudiée.
D'après les résultats, on voit que pour
chaque acide, Qr,eq est
sensiblement constant ( quelle que soit la concentration initiale de
l'acide!).
Qr,eq est
une constante qui caractérise un acide donné.
( en théorie : acide éthanoïque : Qr,eq
= 1,8 × 10-5
acide benzoïque Qr,eq = 6,3× 10-5 )
Données :
Conductivités molaires ioniques à 25° C :
|
Ion |
|
|
Chlorure |
λ (Cl-) =7,63 x 10-3 S.m2.mol-1 |
|
Potassium |
λ (K+) =7,35 x 10-3 S.m2.mol-1 |
|
Oxonium |
λ (H3O+) = 35,0 x 10-3 S.m2.mol-1 |
|
Éthanoate |
λ (CH3COO-) = 4,09 x 10-3 S.m2.mol-1 |
|
Benzoate |
λ (C6H5COO-) = 3,24 x 10-3 S.m2.mol-1 |