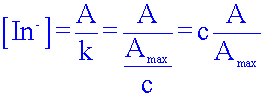
et
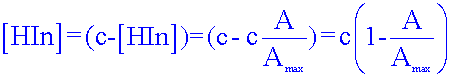

A partir du spectre d'absorption ci-dessus, expliquer pourquoi la forme acide HIn apparaît jaune et la forme basique In - apparaît bleue.
La forme Hin
absorbe dans le bleu : elle est de
couleur jaune.
La forme In–
absorbe dans le jaune orangé: elle est de couleur bleue.
A quelle longueur d'onde, l'absorption de la forme basique In – est-elle maximale ?
( λmax = 620 nm )
A cette longueur d'onde est-ce que la forme acide HIn absorbe la lumière ?
A cette longueur d’onde, la forme acide Hin n’absorbe aucune lumière.
En déduire la relation (1) entre l’absorbance A de cette solution et la concentration effective [In-] de la forme basique, lorsqu'on éclaire une solution diluée de BBT avec une radiation monochromatique de longueur d’onde λb = 620 nm.
A = k [ In- ] ( loi de Beer lambert )
Soit c, la concentration en BBT. En milieu très basique (pH voisin de 11), seule la forme basique bleue de l’indicateur existe en solution et donc [In-] = c.Exprimer l'absorbance A, notée alors Amax, en fonction de la concentration molaire apportée c, en bleu de bromothymol (relation (2).
Amax = k [ In- ]max = k c
En utilisant les deux relations (1) et (2) exprimer la concentration effective [In-] et [HIn] en fonction de c, A et Amax.
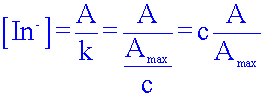
et 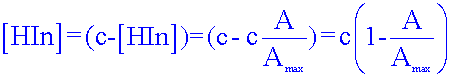
Exprimer alors le pourcentage de la forme basique In- - noté Po(In-)- et le pourcentage de forme acide HIn - noté Po(HIn)- de l’indicateur coloré en fonction de A et Amax.
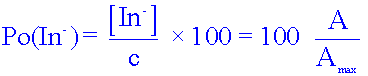 et
et

| N°binôme | 1 | 2 | 3 | 4 |
5 |
6 |
7 |
8 | ||||||||
| Si | S1 | S9 | S2 | S10 | S3 | S11 | S4 | S12 | S5 | S13 | S6 | S14 | S7 | S15 | S8 | S16 |
| pH souhaité | 3,5 | 7,5 | 4,0 | 8,0 | 4,5 | 8,5 | 5,0 | 9,0 | 5,5 | 9,5 | 6,0 | 10 | 6,5 | 10,5 | 7,0 | 11,0 |
| v (mL) | 2,3 | 6,3 | 2,8 | 6,8 | 3,3 | 7,3 | 3,8 | 7,8 | 4,3 | 8,3 | 4,8 | 8,8 | 5,3 | 9,3 | 5,8 | 9,8 |
Construire sur le même graphe les courbes représentatives de l'évolution des valeurs des pourcentages de In et HIn en fonction du pH.
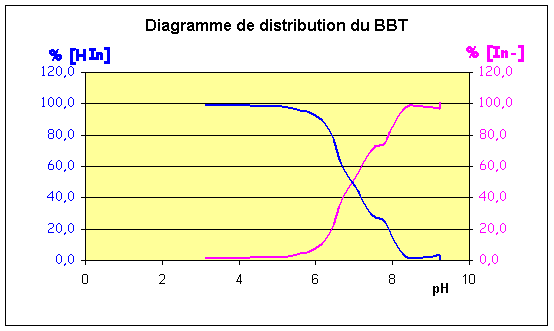
En déduire les domaines de prédominance de chacune des deux formes In- et HIn.
La
forme
acide
Hin prédomine pour pH < 6
la
forme
basique
In- prédomine pour pH > 8
Vérifier l'hypothèse faite pour l'absorbance maximale.
On voit que pour pH = 11 , tout l’indicateur est sous forme basique : Po( Hin ) = 0
Déterminer visuellement la zone de virage de l'indicateur coloré BBT en rassemblant toutes les solutions sur le bureau.
Visuellement la zone de virage est : 6< pH < 8
Déterminer
graphiquement la zone de virage de
l'indicateur coloré BBT sachant que la zone de virage d'un indicateur
coloré
est généralement définie par l'intervalle de pH dans lequel le rapport
des
concentrations molaires des formes acide et basique est compris entre
1/10 et
10, soit 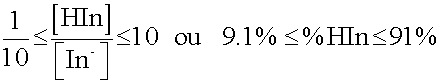
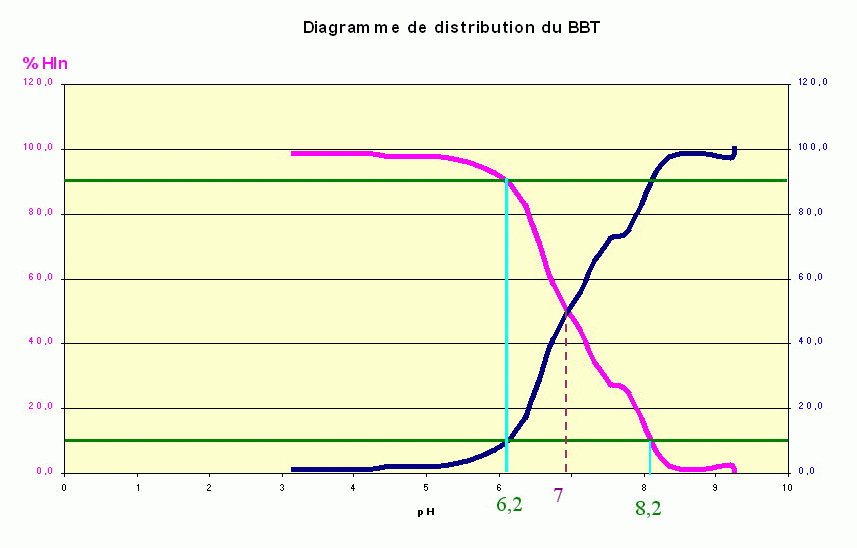
D'après le graphique, la zone de virage est comprise entre pH= 6,2 et pH = 8,2
Remarque :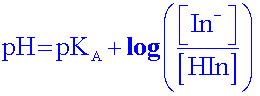
Si Po[ Hin] = Po[ In- ] = 50% alors pH = pKA
D’après la courbe : pKA = 7 pour le BBT ( les autres indicateurs colorés ont un pKA ≠ 7 !!)
voir le tableau des indicateurs colorés