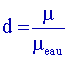 avec µeau = 1g.mL-1 donc
: µéthanol = d×1 = 0,79 g.mL-1
avec µeau = 1g.mL-1 donc
: µéthanol = d×1 = 0,79 g.mL-1
or :
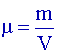 , et, pour une mole, m= M, donc
, et, pour une mole, m= M, donc 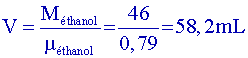
| N° | Mélanges initiaux | Conditions expérimentales | ||
| 1 | Eau
115 mL |
Acide
sulfurique concentré 1 mL |
Indifférent | |
| 2 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Acide
sulfurique concentré 1 mL |
1 semaine à température ambiante |
| 3 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Préparation
en début de séance et à
température ambiante . Titrage à 0 min puis à différentes dates (dont 30 min) |
|
| 4 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Acide
sulfurique concentré 1 mL |
Préparation
en début de séance et à
température ambiante. Titrage à 0 min puis à différentes dates ( dont 30 min) |
| 5 | Éthanol
1,33 mol |
Acide
éthanoïque 0,67 mol |
Acide
sulfurique concentré 1 mL |
1 semaine à température ambiante |
| 6 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Acide
sulfurique concentré 1 mL |
Préparation en début de séance, reflux pendant 20 min et titrage à 30 min |
| 7 | éthanoate
d'éthyle 1 mol |
Eau
1 mol |
Acide
sulfurique concentré 1 mL |
1 semaine à température ambiante |
| Espèce chimique | Masse molaire (g.mol-1) | Densité par rapport à l’eau à 20 °C | θéb (°C) | Concentration molaire (mol.L-1) |
| Acide éthanoïque | 60 | 1,05 | 118 | |
| Éthanol | 46 | 0,79 | 78 | |
| Acide sulfurique concentré | 18 | |||
| Éthanoate d'éthyle | 88 | 0,90 | 78 | |
| eau | 18 | 1,00 | 100 |
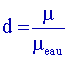 avec µeau = 1g.mL-1 donc
: µéthanol = d×1 = 0,79 g.mL-1
avec µeau = 1g.mL-1 donc
: µéthanol = d×1 = 0,79 g.mL-1
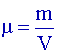 , et, pour une mole, m= M, donc
, et, pour une mole, m= M, donc 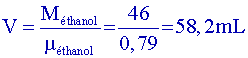
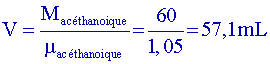 .
.
| mélange | 1 | 2 _ 4 _ 6 | 3 | 5 | 7 |
| Volume (mL) | 116 |
58,2 +57,1 +1 = 116,3 |
58,2 + 57,1 = 115,3 |
1,33×58,2+0,67 × 57,1 +1 =
116,7 |
88/0,90 + 18/1 +1 = 116,8 |
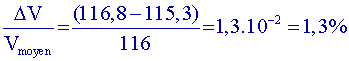
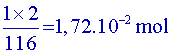 d’acide
éthanoïque.
d’acide
éthanoïque.| N° |
Volume de soude VBE
(mL) (date en min) |
Taux d’avancement τ | ||||||||||
| 1 |
VBE1 = 0,7 mL V = 0,65 mL |
|||||||||||
| 2 | V= 6.6 mL | 0.65 | ||||||||||
| 3 |
0 | 17,0 | 3 | 19,1 | 5 | 0 | -0.05 | 3 | -0.08 | 5 | ||
| 10 | 20,3 | 15 | 19,9 | 20 | 10 | -0,14 | 15 | 20 | ||||
| 30 | 17,3 | 45 | 60 | 30 | 0,04 | 45 | 60 | |||||
| 4 |
0 | 19,0 | 3 | 20,1 | 5 | 24,6 | 0 | -0.07 | 3 | 5 | ||
| 10 | 22,8 | 15 | 19,5 | 20 | 23,2 | 10 | 15 | 20 | ||||
| 30 | 18,6 | 45 | 16,4 | 60 | 30 | -0.04 | 45 | 0.08 | 60 | |||
| 5 |
V= 3,2
mL
V = 3,2
mL |
0.85???? | ||||||||||
| 6 |
V = 6,6 mL V = 6,55 mL |
0,67 | ||||||||||
| 7 |
V = 6,4 mL V = 6,3 mL |
0.33 | ||||||||||
| N° |
Volume de soude VBE
(mL) (date en min) |
Taux d’avancement τ | ||||||||||
| 1 |
VBE1 = 0,6 mL |
|||||||||||
| 2 | V= 6.3 mL | 0.67 | ||||||||||
| 3 |
0 | 17,9 | 3 | 18,2 | 5 | 0 | 0 | 3 | 0 | 5 | ||
| 10 | 18,5 | 15 | 18,2 | 20 | 10 | 15 | 20 | |||||
| 30 | 18,1 | 45 | 18,1 | 60 | 30 | 45 | 60 | |||||
| 4 |
0 | 19,2 | 3 | 18,2 | 5 | 17,8 | 0 | -0.08 | 3 | -0.02 | 5 | 0 |
| 10 | 17,3 | 15 | 17,2 | 20 | 16,9 | 10 | 0.03 | 15 | 0.03 | 20 | 0.05 | |
| 30 | 16,6 | 45 | 14,6 | 60 | 30 | 0.07 | 45 | 0.19 | 60 | |||
| 5 |
V= 1,4
mL
|
????? | ||||||||||
| 6 |
V = 8,1 mL |
0.57 | ||||||||||
| 7 |
V = 6,2 mL |
0,32 | ||||||||||
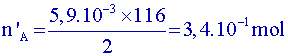
| Acide + alcool = ester + eau | |||||
| Etat initial | x = 0 | 1 | 1 | 0 | 0 |
| Etat intermédiaire | x | 1 - x | 1 - x | x | x |
| Si réaction totale | xmax | 1 - xmax | 1 - xmax | xmax | xmax |
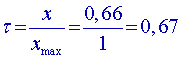
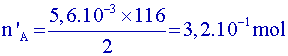
| Ester + eau = acide + alcool | |||||
| Etat initial | x = 0 | 1 | 1 | 0 | 0 |
| Etat intermédiaire | x | 1 - x | 1 - x | x | x |
| Si réaction totale | xmax | 1 - xmax | 1 - xmax | xmax | xmax |
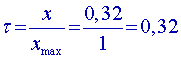
| N° | Mélanges initiaux | Conditions expérimentales | ||
| 1 | Eau
115 mL |
Acide
sulfurique concentré 1 mL |
Indifférent | |
| 2 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Acide
sulfurique concentré 1 mL |
1 semaine à température ambiante |
| 3 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Préparation
en début de séance et à
température ambiante . Titrage à 0 min puis à différentes dates (dont 30 min) |
|
| 4 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Acide
sulfurique concentré 1 mL |
Préparation
en début de séance et à
température ambiante. Titrage à 0 min puis à différentes dates ( dont 30 min) |
| 5 | Éthanol
1,33 mol |
Acide
éthanoïque 0,67 mol |
Acide
sulfurique concentré 1 mL |
1 semaine à température ambiante |
| 6 | Éthanol
1 mol |
Acide
éthanoïque 1 mol |
Acide
sulfurique concentré 1 mL |
Préparation en début de séance, reflux pendant 20 min et titrage à 30 min |
| 7 | éthanoate
d'éthyle 1 mol |
Eau
1 mol |
Acide
sulfurique concentré 1 mL |
1 semaine à température ambiante |
Les résultats des mélanges 2 et 4.
La réaction d’estérification est très lente.
Les
résultats des mélanges 2,5 et 7
Les réactions d’estérification et d’hydrolyse sont des réactions limitées.
Les
résultats des mélanges 3 et 4
L’acide sulfurique est un catalyseur pour la réaction d’estérification
Les
résultats des mélanges 4 et 6
La réaction est plus rapide quand la température augmente.
Les
résultats des mélanges 2 et 6
En chauffant
le
mélange réactionnel, en 1 h, on atteint la même limite qu’au bout d’une
semaine
à froid .
Donc, une augmentation de
température ne modifie pas la limite atteinte.
Les
résultats des mélanges 2 et 5
La composition du mélange réactionnel influe sur la composition du mélange à l’équilibre.