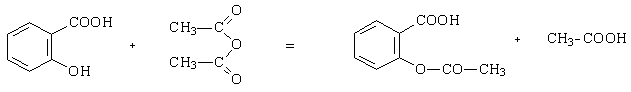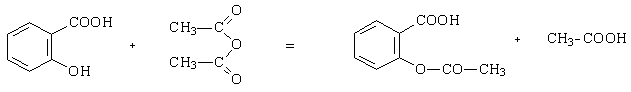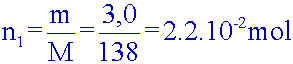Ch
4.2 Hémisynthèse
de l’aspirine à partir d’un anhydride acide
mettre la synthèse en route dès le début de la séance!
1.But
du TP
- Réaliser
au laboratoire l’hémisynthèse d’un médicament, l’aspirine.
- Identifier
le produit obtenu par chromatographie sur couche mince.
- Montrer
que par le choix d’un réactif approprié, il est possible d’améliorer le
rendement d’une transformation.
2.Un
peu d’histoire…
L'aspirine est un médicament,
anti-pyrétique,
anti-inflammatoire et analgésique. Il possède également des propriétés
anti-coagulantes. En 1860, le chimiste allemand Hermann Kolbe réussit
la
synthèse chimique de l’acide salicylique à partir du phénol
(hydroxybenzène),
mais son acidité irrite le tube digestif ; c’est seulement en
1897 que
Félix Hoffmann, jeune chimiste allemand travaillant pour la firme Bayer
trouve
un composé voisin, l’acide acétylsalicylique qui, lui, est bien
supporté par
l’organisme.
3. Présentation
de la démarche
Le
protocole proposé permet de réaliser une
hémisynthèse de l’aspirine (hémi : demi, à moitié). L’ester
(l’aspirine)
est obtenu par réaction entre le groupe hydroxyle porté par l’acide
salicylique
et l'anhydride éthanoïque ; la réaction est catalysée par les
ions H3O+.
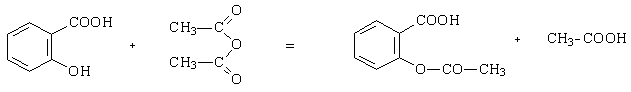
acide
salicylique
anhydride
éthanoïque
aspirine
acide éthanoïque
(acide
2-hydroxybenzoïque)
acide acétylsalicylique
remarque : ici, l'acide salicylique réagit par sa fonction phénol...
4.Données
physico-chimiques
|
M (g.mol-1
)
|
Densité
|
Tfus ( °C )
|
Teb ( °C )
|
|
Acide salicylique
|
138
|
|
159
|
211
|
|
Anhydride éthanoïque
|
102
|
1,082
|
- 73
|
136,4
|
|
Acide acétylsalicylique
|
180
|
|
entre 135 et 140
|
|
Solubilité
:
L’anhydride éthanoïque et l’acide éthanoïque sont solubles
dans
l’eau et l’éthanol.
L’hydrolyse de l’anhydride éthanoïque est
relativement
lente à froid.
L’acide
salicylique est peu soluble dans l’eau à
froid, mais soluble à chaud, et très soluble dans l’alcool et l’éther.
L’aspirine
est très peu soluble dans l’eau à froid
mais très soluble par contre, dans l’éthanol.
Quel
est
l’état physique de chacun des réactifs
et des produits à 60°C ?à
0°C ?
A
0°C, comme à
60°C ,
L’acide salicylique et l’aspirine sont solides
L’anhydride éthanoïque et
l’acide éthanoïque sont liquides
5.Synthèse
5.1
Manipulation
(Utiliser
de la verrerie bien sèche)
Préparer
un bain-marie
maintenu entre
50° et 60° C.
Sous
hotte, introduire, dans un
erlenmeyer sec de 250 mL, 3,0 g d’acide salicylique puis, avec
précaution, 6 mL
d’anhydride acétique (éthanoïque ). Ajouter 3 à 4 gouttes d’acide
sulfurique
concentré.
Adapter
un réfrigérant à
boules et chauffer au bain-marie
pendant une quinzaine de minutes en agitant par intermittence.
5.2
Questions
Au
vu de la réaction, pourquoi l’hydrolyse de l’acide acétylsalicylique ne
peut-elle avoir lieu ?
Il n'y a pas d'eau formée ; l'hydrolyse
ne peut donc pas avoir lieu..
Pourquoi
recommande-t-on
d’utiliser de la verrerie bien sèche ?
Pour éviter toute présence d'eau.
Quels
sont les moyens mis en jeu pour augmenter la vitesse de
réaction ?
On chauffe le mélange réactionnel, on
met un catalyseur ( acide sulfurique)
Pourquoi
utilise-t-on un montage à reflux ?
Pour éviter toute perte de matière
Déterminer
la quantité de matière des réactifs mis en jeu. L’un d’entre eux est-il
en
excès ?
Acide
salicylique : 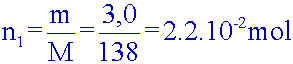
Anhydride
éthanoïque : 
|
|
|
Ac. Salicylique +
Anhydride = aspirine + ac.éthanoïque
|
| E.I
|
x = 0
|
n1
|
n2
|
0
|
0
|
| Si réaction totale
|
xmax |
n1
- xmax |
n2
- xmax |
xmax |
xmax |
xmax = n1 = 2,2.10-2 mol
Quelle
quantité d’aspirine
peut-on espérer obtenir ?
On
peut récupérer au maximum : xmax
= 2,2.10-2 mol soit m = 2,2.10-2×180
= 4,0 g
A
la fin de la réaction, quelles espèces y a-t-il dans
l’erlenmeyer ? Sous
quelle forme est l’aspirine ?
De
l’aspirine
De l’acide éthanoïque
De l’anhydride
éthanoïque en excès.
L’aspirine, bien que
solide, est dissoute dans le mélange
réactionnel (elle est soluble à chaud)
6. Cristallisation
de l’acide acétylsalicylique
prévoir 40 min
6.1
Manipulation
Retirer
l’erlenmeyer du
bain-marie en maintenant la circulation d’eau dans le réfrigérant et
verser
aussitôt, par petites quantités, par le sommet du réfrigérant, environ
30 mL
d’eau distillée froide.
Enlever
le réfrigérant après
avoir arrêté la circulation d’eau et continuer à agiter doucement
jusqu’à
l’apparition des premiers cristaux. Rajouter alors 30 mL d’eau glacée
et
placer, sans agiter, l’erlenmeyer dans un bain eau-glace pendant une
dizaine de
minutes.
Filtrer
alors le mélange
obtenu sur Büchner ( voir animation ) en tirant sous vide à la trompe à eau. Rincer
l’erlenmeyer
avec un peu d’eau froide pour entraîner tout le solide sur le filtre.
Interrompre l’aspiration et laver les cristaux retenus sur le filtre
avec un
peu d’eau froide. Rétablir l’aspiration pour essorer les cristaux.
Sécher
le produit obtenu (
étuve ou chauffe-ballon + grille).
Peser
le produit sec.
6.2
Questions
Pourquoi,
après avoir retiré l’erlenmeyer du bain-marie, verse-t-on de l’eau
distillée
froide ?
L’anhydride
éthanoïque réagit avec l’eau ( hydrolyse ) et forme de l’acide
éthanoïque.
Écrire
la réaction
d’hydrolyse de l’anhydride éthanoïque en excès.

il se forme de l'acide éthanoïque qui réagit en partie avec l'eau:
CH3COOH + H2O = CH3COO-+ H3O+
Que
reste-t-il alors dans
l’erlenmeyer ?
Des
ions CH3COO-et H3O+
et de
l’aspirine
Justifier
l’apparition de cristaux lors de l’ajout d’eau glacée.
L’aspirine est
très peu soluble dans l’eau à froid, donc elle cristallise.
Quelle
est la principale impureté éliminée par filtration ?
L’acide
éthanoïque.
7.CARACTERISATION DU PRODUIT OBTENU
Le produit est identifié par chromatographie sur couche mince (CCM)
7.1 Rappels sur la chromatographie
La
plaque pour chromatographie est constituée d’une feuille d'aluminium
sur
laquelle est déposée une couche mince de silice poreuse. Cette mince
couche
constitue la phase stationnaire.
La partie inférieure de cette plaque
est
plongée dans un solvant liquide ou un mélange de solvants appelé
éluant. Le
solvant s'élève par capillarité le long de la couche mince : il
constitue la
phase mobile.
La chromatographie est basée sur la différence
d’adsorption
des
constituants du mélange sur la phase fixe balayée par l’éluant (voir
animation).
Une
substance,
soluble dans l’éluant, est entraînée le long de la couche mince, ce
phénomène
est appelé élution. Plus la solubilité de la substance dans l’éluant
est
grande, plus la distance parcourue par elle le long de la couche mince
est
grande. On définit pour une espèce chimique donnée, le rapport frontal
(Rf)
par le rapport de la distance parcourue par l’espèce chimique (milieu
de la
tache) sur celle parcourue par l’éluant (front).
7.1 Manipulation
Animation sur
la technique
de chromatographie.
Préparer la cuve à chromatographie avec comme éluant un mélange
d’acétate d’éthyle/cyclohexane/acide formique dans les proportions
60/40/10 en volumes.
Préparer les solutions à déposer sur la plaque de silice, le solvant utilisé ici étant l’acétate d’éthyle :
- Acide salicylique pur du commerce : une pointe de spatule dissous dans 1 mL environ d’acétate d’éthyle ;
- Acide acétylsalicylique résultant de la synthèse : une pointe de
spatule du produit brut préparé dissous dans 1 mL environ d’acétate
d’éthyle ;
- Aspirine officinale : écraser dans un mortier un comprimé ( ou
utiliser le médicament en poudre, Aspégic® ), et dissoudre une petite
quantité (une pointe de spatule) dans 1mL environ d’acétate d’éthyle.
Tracer, à l’aide d’un crayon, un trait fin à 1cm environ du bord inférieur de la plaque CCM.
Effectuer les dépôts sur la plaque CCM, mettre la plaque dans la cuve et couvrir. Laisser migrer l’éluant.
Repérer le front du solvant, sécher la plaque et révéler sous UV. Entourer les taches d’un léger trait de crayon.
7.2 Questions
Calculer les rapports frontaux, Rf.
Interpréter les calculs des rapports frontaux Rf et conclure quant à la pureté du produit préparé.