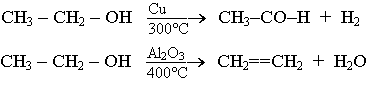Un catalyseur est une espèce chimique qui augmente la vitesse de réaction, mais ne modifie pas l’état d’équilibre du système.
Si
une substance catalyse une
réaction, elle catalyse aussi la réaction inverse.
Ecrire l’équation de cette réaction :

Une catalyse est homogène lorsque le catalyseur et les réactifs sont dans le même état physique.
Expérience : Mise en évidence de l’influence de la concentration du catalyseur.
introduire 15mL d’eau oxygénée ( 20V) dans 2 tubes à essais.Observations :
La réaction est beaucoup plus rapide dans le tube 1
Conclusion :
Lors
d’une
catalyse homogène, le catalyseur est d’autant plus actif, qu’il est
plus
concentré.
Autre
exemple de catalyse homogène :
les ions H+ dans la réaction d’estérification
hydrolyse.
Une catalyse est hétérogène lorsque le catalyseur et les réactifs ne sont pas dans le même état physique.
Expérience
Introduire 15mL d’eau oxygénée ( 20V) dans 2 tubes à essais.Observations :
La réaction est beaucoup plus rapide dans le tube 2
La
réaction chimique a lieu à la surface
du catalyseur ( adsorption)
Lors d’une catalyse hétérogène, le catalyseur est d’autant plus actif, que sa surface est plus grande.

Dans l’industrie , les catalyseurs sont souvent sous forme de « mousse » ou de « toile »
( ici : mousse de silicium)
remarque : certains corps peuvent annuler le pouvoir d’un catalyseur : "poison d’un catalyseur" ( ex : plomb pour les pots d’échappement catalytiques )
Une catalyse est enzymatique lorsque le catalyseur est une enzyme, protéine élaborée par les organismes vivants.
Expérience
Introduire
15mL d’eau oxygénée
( 20V) dans 1 tube à essais puis quelques morceaux de pomme de terre
Observations :
La réaction est beaucoup plus rapide dès que l’on introduit les morceaux de pomme de terre ( qui contient une enzyme : la catalase)
 Les
enzymes contiennent des sites actifs
( cavités ) dans lesquels les particules de réactif se fixent pour
réagir. Plus
le nombre de sites actifs est élevé, plus le catalyseur est efficace.
Les
enzymes contiennent des sites actifs
( cavités ) dans lesquels les particules de réactif se fixent pour
réagir. Plus
le nombre de sites actifs est élevé, plus le catalyseur est efficace.Quand on chauffe de l’éthanol :