Ch
1.2
EXTRACTION
DE L’EUGENOL DES CLOUS DE GIROFLE
1.Presentation
1.1- Les huiles essentielles
De nombreux végétaux contiennent des substances odorantes,
volatiles et peu solubles dans l’eau appelées « huiles
essentielles ». (La volatilité des huiles essentielles les
oppose aux huiles
fixes
qui sont des lipides.)
Ces huiles essentielles sont
des mélanges de
constituants
plus ou moins nombreux, généralement liquides. Les principaux
constituants des HE
responsables de l’odeur appartiennent aux différentes fonctions de la
chimie
organique. Leurs propriétés
physiques
rendent leur extraction par entraînement à la vapeur particulièrement
aisée .
1.2 Les clous de girofle
 Le
giroflier, eugenia
caryophyllata (nom donné par Pline, du grec phullon
: feuille et karyon : noyau, noix) est un bel arbre de 12 à
15 m de haut, de la famille des Myrtacées à feuillage persistant,
exigeant un
climat doux et humide.
Le
giroflier, eugenia
caryophyllata (nom donné par Pline, du grec phullon
: feuille et karyon : noyau, noix) est un bel arbre de 12 à
15 m de haut, de la famille des Myrtacées à feuillage persistant,
exigeant un
climat doux et humide.
Les clous de girofle, pimenta
dioica, sont les bourgeons séchés, non éclos, du giroflier et
sont parmi
les plus anciennes épices et drogues décrites dans l'histoire. Le clou
de
girofle est connu en Chine au IIIe
siècle avant notre ère, en Europe seulement au XIIe
siècle, mais peu consommé en raison de son
prix élevé ; la consommation se généralise au XVIe
siècle. Ce sont les Portugais qui, parvenus
au pays du girofle, l'ont expédié par cargaisons à Lisbonne. En 1605,
les
Hollandais prennent possession des Moluques et ont le monopole
commercial. Sous
Louis XV, Pierre Poivre réussit à se procurer des pieds de girofliers
et de
muscadiers et les introduit en France et aux îles Bourbon (aujourd'hui
La
Réunion et Maurice).
Les grands pays exploitants sont la république Malgache, la
Tanzanie, l’Indonésie et le Sri Lanka.
Les clous de girofle sont principalement utilisés comme épice. (En Indonésie, ce produit est largement utilisé dans la
fabrication de
cigarettes 60 % de tabac, 40 % de girofle).
1.3 L’eugénol
L'huile essentielle des clous de girofle contient
principalement de l'eugénol (75 à 85 %), de l'acétate d’eugénol ou
acétyleugénol (4 à 10 %), un peu d’hydrocarbures et de petites
quantités de
dérivés cétoniques et d’esters.
Eugénol : 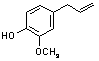 acétyleugénol
acétyleugénol 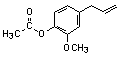
L'eugénol,
extrait de l'huile essentielle des clous de
girofle ou des feuilles de giroflier, est utilisé dans certains
produits des
domaines médical et dentaire en raison de ses propriétés antalgique et
antiseptique.
Caractéristiques
de l’eugénol (C10H12O2):
Tf =
- 9°C
Téb = 253°
C d
= 1,06
Très peu soluble dans l’eau
Insoluble
dans l’eau
salée
Très soluble dans le dichlorométhane (d = 1,33)
ou dans l’éther (d = 0,71)
2. Manipulation
2.1
Hydrodistillation
Introduire dans un
ballon de 250 mL, 10 g de clous de girofle
broyés, quelques grains de pierre ponce et 120 mL d’eau environ.
Réaliser le
montage d’hydrodistillation et chauffer (ébullition modérée) jusqu’à
recueillir
environ 80 mL de distillat.
Faire un schéma et expliquer en
quelques
lignes cette
technique d’extraction par entraînement à la vapeur.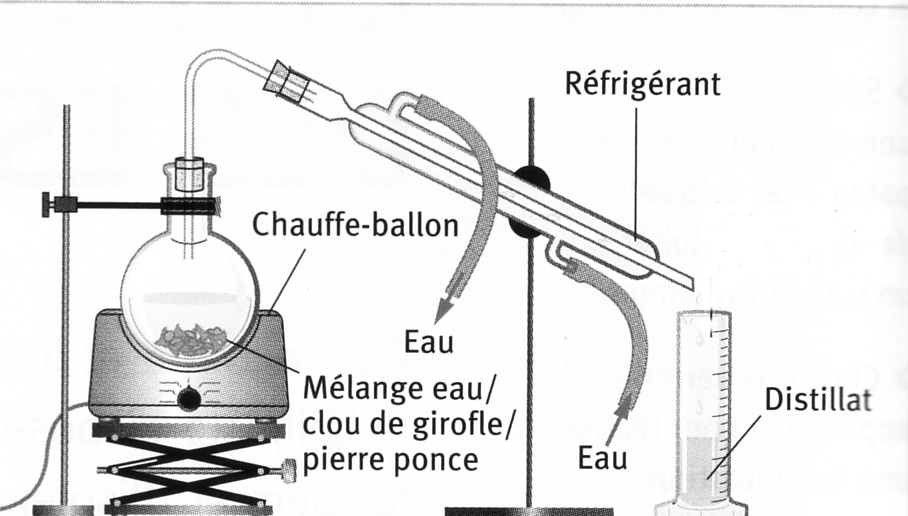
Les
clous de girofle contenant l’eugénol sont placés dans de l’eau en ébullition ("décoction").
En se vaporisant, l’eau entraîne
l’huile essentielle.
Les
vapeurs
arrivent dans
le réfrigérant où elles se condensent. Elles s’écoulent à l’état
liquide et
forment le distillat.
Quelle température indique le
thermomètre
lors de
l’hydrodistillation ?
inférieure à 100 °C. ( l'eau
n'est pas pure )
Expliquer le trouble du
distillat.
il
est dû à une émulsion
: le distillat est un mélange hétérogène
d’huile essentielle et
d’eau.
(l’huile essentielle est composée de molécules
apolaires alors
que le
solvant, l’eau, est polaire; de ce fait, les espèces présentes dans
l’huile
essentielle sont peu
solubles dans l’eau).
2.2
Extraction
liquide-liquide
Ajouter au
distillat une spatule de chlorure de sodium.
Agiter jusqu’à dissolution. Verser le distillat dans une ampoule à
décanter.
Agiter et laisser décanter.
Pourquoi
ajoute-t-on du
chlorure de
sodium
au
distillat?
La
solubilité de
l’huile essentielle étant moins importante dans l’eau salée que dans
l’eau, le
chlorure de sodium favorise la séparation des 2 phases : c’est
le relargage
Ajouter 15 mL de dichlorométhane dans l’ampoule à
décanter. Agiter en effectuant, de temps à autre, un dégazage. Laisser
décanter.
Représenter l’ampoule à
décanter en
précisant les phases.
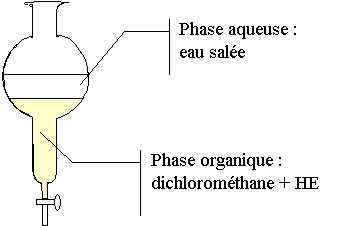
La phase
organique se trouve sous la phase aqueuse car le
dichlorométhane est plus dense que l’eau.
Extraire la phase organique
(cette solution contient de l’eugénol et
de l’acétyleugénol).
1.3 Séparation de
l’eugénol et de l’acétyleugénol :
Verser dans l’ampoule à
décanter vide la phase organique.
Ajouter à cette phase 15 mL de solution de soude de
concentration 2
mol.L-1.
Agiter, laisser décanter et récupérer la phase aqueuse.
L’eugénol
est un phénol qui se transforme en ion eugénolate sous l’action de la
solution
de soude.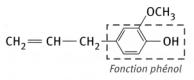
Ecrire l'équation de la réaction entre
l'eugénol et la soude
Ar-OH
+ HO-(aq) =
Ar-O-(aq)
+ H2O
tout l'eugénol réagit
avec la soude. Les ions eugénolate Ar-O-(aq)
sont parfaitement solubles dans la solution aqueuse; il ne reste donc
plus d'eugénol dans la phase organique.
L’acétyleugénol
peut-il faire la même réaction ?
Où se trouve-t-il alors?
L'acétyleugénol
 ne
possède pas cette fonction phénol ; il ne réagit pas avec la soude
et reste dans la phase organique.
ne
possède pas cette fonction phénol ; il ne réagit pas avec la soude
et reste dans la phase organique.
Dans la phase
aqueuse précédente, introduire une solution
d’acide chlorhydrique concentré (6 mol.L-1 )
jusqu’à obtenir un pH
acide (3-4 environ); évaluer avec un papier pH. Une émulsion
se forme alors.
Décrire
brièvement la technique
du
contrôle du pH avec le
papier pH :
Découper un
petit morceau de papier pH, le déposer sur un verre de
montre, toucher la solution avec un agitateur en verre, humecter le
papier pH
avec l’agitateur et comparer à l’échelle de référence.
L’eugénol est régénéré par
action de la
solution d’acide
chlorhydrique ;
écrire l’équation de la
réaction qui se
produit avec l’ion
eugénolate :
Ar-O-
(aq)+ H3O+(aq)
=
Ar-OH + H2O
Cette réaction régénère
l'eugénol.
Interpréter l’émulsion
observée :
L’émulsion
est
due aux gouttelettes d’eugénol dans l’eau.
Quel est le but des 2 réactions
acido-basique effectuées?:
séparer
l’eugénol
de
l’acétyleugénol.
Utiliser l’ampoule à décanter pour extraire
la phase
organique avec 15 mL de dichlorométhane.
A ce stade, dans la phase organique, il
n'y a que
de l'eugénol dissout dans le dichlorométhane.
2.4 Identification de l’eugénol
extrait :
Réaliser cette identification par CCM.
L’éluant est un mélange de toluène et d’éthanol dans les
proportions 94/6.
Identifier l’eugénol extrait en le comparant à de l’eugénol
pur.
Les taches seront révélées sous UV (254 nm).
Remarque :
L’eugénol extrait étant mélangé à du dichlorométhane, il sera
nécessaire de
faire plusieurs dépôts successifs en un même point, en faisant évaporer
le
dichlorométhane entre chaque dépôt, pour que la quantité d’eugénol
déposé soit
suffisante. ( Téb (dichlorométhane) =
39,8° C)
Faire un schéma du chromatogramme et
conclure.


 Le
giroflier, eugenia
caryophyllata (nom donné par Pline, du grec phullon
: feuille et karyon : noyau, noix) est un bel arbre de 12 à
15 m de haut, de la famille des Myrtacées à feuillage persistant,
exigeant un
climat doux et humide.
Le
giroflier, eugenia
caryophyllata (nom donné par Pline, du grec phullon
: feuille et karyon : noyau, noix) est un bel arbre de 12 à
15 m de haut, de la famille des Myrtacées à feuillage persistant,
exigeant un
climat doux et humide.
 acétyleugénol
acétyleugénol 



 ne
possède pas cette fonction phénol ; il ne réagit pas avec la soude
et reste dans la phase organique.
ne
possède pas cette fonction phénol ; il ne réagit pas avec la soude
et reste dans la phase organique.