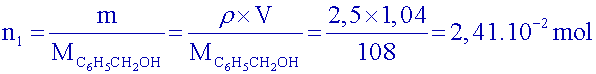
Quantité de permanganate:
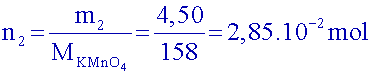
 ou
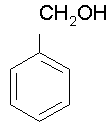
C6H5–CH2OH
en présence d’un oxydant puissant :
l’ion permanganate MnO4-.
ou
C6H5–CH2OH
en présence d’un oxydant puissant :
l’ion permanganate MnO4-.
Ecrire les 2 demi-équations d’oxydoréduction des couples : MnO4-(aq) /MnO2(s) et C6H5CO2-(aq)/ C6H5–CH2OH(aq) en milieu basique. Montrer alors que l’on obtient l’équation bilan (1) en milieu basique.
MnO4-(aq)
+ 2 H2O + 3 e-
= MnO2(s) +
4 HO-(aq)
×4
C6H5–CH2OH(aq)
+ 5 HO-(aq)
= C6H5CO2-(aq)
+
4 H2O + 4e-
×3
_______________________________________________________________________________
3 C6H5–CH2OH(aq)
+ 4 MnO4-(aq)
= 3 C6H5CO2-(aq)
+ 4 MnO2(s) + OH-(aq)
+ 4 H2O (1 )
Quel composé permet d’obtenir un milieu réactionnel basique ? Justifier.
l’ion carbonate CO32-
est la base du couple
HCO3-/CO32-
CO32-(aq)
+ H2O = HCO3-(aq)
+ HO-(aq)
Calculer les quantités de matière d’alcool benzylique et d’ions permanganate introduites sachant que l’on prélève 2,5 mL d’alcool et 4,50 g de permanganate.
Données :Quantité d'alcool benzylique : 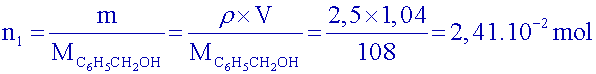
Quantité de permanganate: 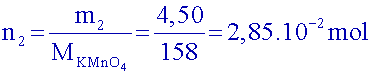
Etablir le tableau d’avancement relatif à la transformation précédente. Quel est le réactif limitant de la réaction ?
| 3 C6H5–CH2OH(aq) + 4 MnO4-(aq) = 3 C6H5CO2-(aq) + 4 MnO2(s) + OH-(aq) + 4 H2O | |||||||
| E. I | x = 0 | n1 | n2 | 0 | 0 | 0 | / |
| E inter | x | n1- 3 x | n2 - 4 x | 3 x | 4x | x | / |
| E final | xmax | n1- 3 xmax | n2 - 4 xmax | 3 xmax | 4 xmax | xmax | / |
si l'alcool benzylique est réactif limitant :

si les ions permanganate sont réactif limitant:

Donc les ions permanganate sont réactif limitant et xmax =
7,12.10-3 mol
Pourquoi chauffe-t-on à reflux ?
La réaction est lente à froid : il faut donc chauffer...On chauffe à reflux pour éviter les pertes de matière.
Faire
le schéma du montage à reflux, légendé.

Quel est le rôle de la pierre ponce ?
Elle sert à homogénéïser la mélange réactionnel
Pourquoi ne faut-il pas arrêter le réfrigérant tout de suite après la fin du chauffage ?
Pour condenser les dernières vapeurs.
Quelle est la couleur du mélange réactionnel en fin de réaction ? A quel corps est dûe cette couleur ?
Marron ; c'est dû au dioxyde de manganèse MnO2.
Quelle est la couleur du filtrat ?
Le filtrat est incolore
Sachant que les ions permanganate MnO4-(aq) introduits en début d’expérience sont violets, comment peut-on expliquer la couleur du filtrat ?
Les ions MnO4-(aq) sont le réactif limitant; ils ont donc tous disparu. ( la couleur violette aussi...)
Quel solide est éliminé lors de cette filtration ?
Le dioxyde de manganèse MnO2
Schématiser
le dispositif de filtration. Que contient
le filtrat ?
l'alcool benzylique C6H5–CH2OH restant, des ions benzoate C6H5–CO2- formés en milieu basique et les ions HCO3- , K+, Na+ qui n’ont pas réagi.
L’ion
carbonate CO32-(aq)
est la
base du couple HCO3-(aq)/CO32-(aq).
HCO3-(aq)
est une
espèce chimique amphotère
puisqu’elle est aussi dans le couple
CO2(g)/HCO3-(aq).
Rappeler
le sens du mot amphotère puis
justifier l’apparition du dioxyde de carbone lors de l’ajout d’acide
chlorhydrique. Ecrire les équations des transformations chimiques
observées.
Justifier
la précipitation de l’acide benzoïque à
partir de la réaction acido-basique observée.
Une espèce chimique amphotère est un
acide dans un couple et une base dans un autre couple.
HCO3-(aq)
+ H3O+(aq)
= CO2(g) + 2 H2O
C6H5–CO2-(aq)
+ H3O+(aq)
= C6H5–CO2H(s)
+
H2O ( réaction 2 )
Il se forme bien du dioxyde de carbone CO2(g)
et de l'acide carboxylique C6H5–CO2H(s)
Pourquoi lave-t-on l’acide benzoïque à l’eau glacée ?
L'acide benzoïque est très peu soluble dans l'eau glacée : il précipite.
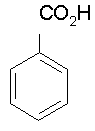
Quelle masse d’acide benzoïque peut-on espérer obtenir (en supposant la réaction totale?)
Dans la réaction 1, il s'est formé : 3 xmax
d'ions benzoate. (xmax =
7,12.10-3 mol)
D'après la réaction 2, il se forme autant d'acide benzoique
qu'il y avait d'ions benzoate.
Il devrait donc se former 3 xmax
mol
d'acide benzoïque, soit une masse :
m = 3 xmax
× Macide
= 3 ×
7,12.10-3 ×
122 = 2,61 g
Quel est alors le rendement de votre préparation ? Commenter la réponse en cherchant les raisons expliquant l’écart observé.
Le rendement
est
inférieur à 100% car :
-
l’avancement maximal
n’était peut-être pas atteint (on aurait dû chauffer plus longtemps)
- les ions
benzoate ne
sont peut-être pas tous récupérés dans le filtrat
- de l’acide
benzoïque
peut-être resté en solution