
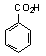
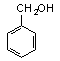
 ou C6H5–CH2OH
en
présence d’un oxydant puissant :
l’ion permanganate MnO4-.
ou C6H5–CH2OH
en
présence d’un oxydant puissant :
l’ion permanganate MnO4-.
3 C6H5–CH2OH(aq) + 4 MnO4-(aq) = 3 C6H5–CO2-(aq) + 4 MnO2(s) + OH-(aq) + 4 H2O ( 1)
Ecrire les 2
demi-équations d’oxydoréduction des
couples :
MnO4-(aq)
/MnO2(s) et C6H5–CO2(aq)-/
C6H5–CH2OH(aq) en milieu
basique.
Montrer alors que l’on obtient l’équation
bilan (1)
en milieu
basique.
C6H5–CH2OH(aq)
+ 5 HO-(aq)
= C6H5–CO2-(aq)
+ 4 H2O + 4e-
× 3
MnO4-(aq)
+ 2 H2O
+ 3 e-
= MnO2(s)
+ 4 HO-(aq)
× 4

3 C6H5–CH2OH(aq) + 4 MnO4-(aq) = 3 C6H5–CO2-(aq) + 4 MnO2(s) + HO-(aq) + 4 H2O
Quel composé permet d’obtenir un milieu réactionnel basique ? Justifier.
le carbonate de sodium : l’ion carbonate CO32- est la base du couple HCO3-(aq)/CO32- (aq)
CO32-(aq) + H2O = HCO3-(aq) + HO-(aq)
Calculer les quantités de matière d’alcool benzylique et d’ions permanganate introduites sachant que l'on prélève 2,50 mL d'alcool et 4,50 g de permanganate..
Données :
Masses
molaires : M(KMnO4) = 158 g.mol-1 ;
M(C6H5–CH2OH)
= 108 g.mol-1 ;
M(C6H5–CO2H
) = 122 g.mol-1
Masse volumique de l’alcool benzylique : ρ =1,04 g.cm-3
= 1,04 g.mL-1
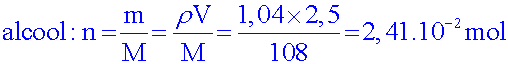
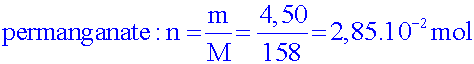
Etablir
le tableau
d’avancement relatif à la
transformation
précédente.
Quel est le réactif
limitant de la réaction ?
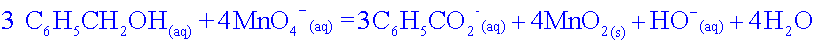 |
|||||||
| E.I | x=0 | 2,41.10-2 | 2,85.10-2 | 0 | 0 | / | / |
| E. inter | x | 2,41.10-2 - 3 x | 2,85.10-2 - 4x | 3x | 4 x | / | / |
| E.F | xmax | 2,41.10-2
- 3 xmax = 2,73.10-3 |
2,85.10-2
- 4 xmax = 0 |
3
xmax = 2,14 .10-2 |
4 xmax = 2,85.10-2 |
/ | / |
Si
l'acide benzoïque est le réactif limitant : 2,41.10-2
- 3 xmax=
0 d'où xmax=
8,03.10-3 mol
Si le permanganate
est le réactif limitant :2,85.10-2 - 4
xmax
= 0 d'où xmax
= 7,13.10-3 mol
Le
permanganate est le réactif limitant.
Pourquoi chauffe-t-on à reflux ?
pour obtenir une vitesse de réaction la plus élevée possible sans perdre ni réactifs ni produits.
Faire
le schéma du montage à reflux, légendé.
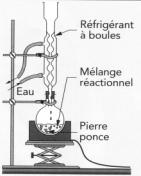
Quel est le rôle de la pierre ponce ?
La pierre ponce permet de réguler l’ébullition et d’homogénéiser la température du milieu.
Pourquoi ne faut-il pas arrêter le réfrigérant tout de suite après la fin du chauffage ?
Pour condenser les dernières vapeurs
Quelle est la couleur du mélange réactionnel en fin de réaction ? A quel corps est due cette couleur ?
Marron ; ceci est dû à la présence de MnO2
Quelle est la couleur du filtrat ?
incolore
Sachant que les ions permanganate MnO4-(aq) introduits en début d’expérience sont violets, comment peut-on expliquer la couleur du filtrat ?
les ions MnO4- sont le réactif limitant ; ils ont tous été consommés.
Quel solide est éliminé lors de cette filtration ?
MnO2
Schématiser le dispositif de
filtration. Que
contient le
filtrat ?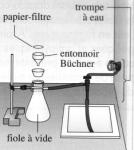
Les ions benzoate C6H5–CO2- formés en milieu basique, l'alcool benzylique C6H5–CH2OH restant et les ions HCO3- , K+, Na+ qui n’ont pas réagi. (Les ions benzoate C6H5–CO2- sont dans la phase liquide car ils sont très solubles dans l'eau )
Rappeler le sens du mot "amphotère".
espèce chimique acide qui est à la fois acide et basique.
Justifier l’apparition du dioxyde de carbone lors de l’ajout d’acide chlorhydrique. Ecrire les équations des transformations chimiques observées.
HCO3-(aq) + H3O+(aq) = CO2(g) + 2 H2O
C6H5–CO2-(aq) + H3O+(aq) = C6H5–CO2H(s) + H2O
Justifier la précipitation de l’acide benzoïque à partir de la réaction acido-basique observée.
En milieu acide, l’acide benzoïque formé, peu soluble dans l’eau, apparaît à l’état solide.
Pourquoi lave-t-on l’acide benzoïque à l’eau glacée ?
A basse température l’acide benzoïque est très peu soluble dans
l’eau.
Donc, il précipite davantage.
Quelle masse
d’acide benzoïque peut-on espérer
obtenir en
supposant la réaction totale ?
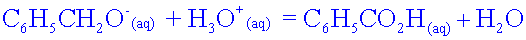 |
|||||
| E.I | x = 0 | 2,14.10-2 | / | 0 | / |
| E. inter | x | 2,14.10-2 - x | / | x | / |
| E.F | xmax | 2,14.10-2 - xmax = 0 |
/ | xmax = 2,14 .10-2 |
/ |
m(C6H5–CO2H)attendue
= 2,14. 10-2 ×122 = 2,6 g
Quel est alors le
rendement ( noté ρ ou η ) de votre préparation ?
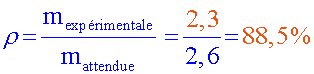
Commenter la réponse en cherchant les raisons expliquant l’écart observé:
Le rendement est
inférieur à 100% car :
-
l’avancement maximal
n’était peut-être pas atteint (on aurait dû chauffer plus longtemps)
- les ions benzoate ne
sont peut-être pas tous récupérés dans le filtrat
- de l’acide benzoïque
est peut-être resté en solution