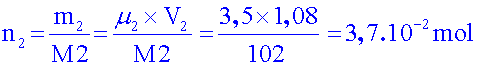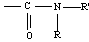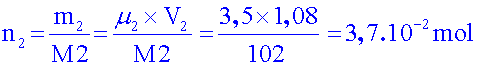Ch
2.2 Synthèse d’un amide : le paracétamol
voir livre p 198
1.Qu’est-ce
qu’un amide ?
1.1 Groupe
amide
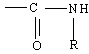
Un amide est
caractérisé par le
groupe 
Les
différentes formules possibles
sont :

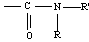
1.2
Nomenclature
Le nom des amides s’obtient à
partir de celui de l’acide carboxylique en supprimant le mot acide et
en
remplaçant la terminaison oïque par amide (exemple : CH3─
CO ─ NH2 s’appelle l’éthanamide).
On obtient un amide en faisant
réagir une amine (R ─ NH2) avec soit un l’acide
carboxylique à
chaud (R’─ COOH) soit un anhydride d’acide (R’─ CO ─ O
─ CO ─ R’’).
2. Le
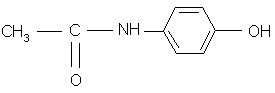
paracétamol
Le paracétamol (4-hydroxyacétanilide) a pour
formule :
CH3 ─ CO ─ NH ─ C6H4
─ OH
Le
paracétamol a une activité
analgésique et antipyrétique d'intensité comparable à celle de
l'aspirine mais
il n'a pratiquement pas d'effet sur l'inflammation. Il n'a pas les
effets
secondaires de l'aspirine, il ne provoque pas de lésion de la muqueuse
gastrique et n'interfère pas avec l'agrégation plaquettaire (ne retarde
pas la
coagulation sanguine). Toutefois, des doses excessives de paracétamol
peuvent
entraîner une nécrose hépatique.
Le début de son activité clinique
date de 1893. Il est présent dans de nombreux médicaments (Doliprane,
Dafalgan,
Efferalgan, …).
3. Synthèse
du paracétamol
3.1 Généralités

Remarque :
quand les
groupes hydroxyle (-
OH) et amino (-NH2) sont en position
1-4
sur un noyau benzénique, cette position est appelée «para ».
Composé |
Aspect à 25°C et sous 105 Pa
|
Risques |
Solubilité
dans l’eau |
Température
de fusion sous 105 Pa
(1 bar) |
Température
d’ébullition sous 105 Pa
(1 bar) |
densité |
Masse
molaire
(g.mol-1) |
| para
-aminophénol |
solide
blanc |
toxique
par inhalation et contact
cutané |
8
g.L-1 à 20°C
33
g.L-1 à
60°C
85
g.L-1 à
100°C |
186
°C |
|
|
109 |
Anhydride
éthanoïque |
liquide
incolore |
corrosif,
inflammable et irritant
pour la peau et les yeux |
réagit
avec l’eau en donnant l’acide
dont il est issu |
-
73°C |
136°C |
1,08 |
102 |
| Paracétamol |
solide
blanc |
|
10
g.L-1 à
20°C
250
g.L-1 à
100°C |
171
°C |
|
|
151 |
| Acide
éthanoïque |
liquide
incolore |
corrosif
et inflammable |
Très
grande solubilité de 0° C à
100°C |
17°C
|
118°C |
1,05 |
|
3.2 Dissolution
du 4-aminophénol
La réaction se faisant en phase liquide, il
est nécessaire,
dans un
premier temps, de dissoudre le 4-aminophénol.
Cette dissolution se fait, à chaud, avec une solution d’acide
éthanoïque.
Les volumes d’anhydride
éthanoïque et d’acide éthanoïque nécessaires
dans ce qui suit, seront prélevés sous la hotte et placés dans des
tubes à
essai fermés par un bouchon pour les emmener
jusqu’à la paillasse où a
lieu la manipulation.
1) Manipulation
- Dans
un erlenmeyer
de 100 mL, introduire 2,8 g de
para-aminophénol, 25 cm3 d’eau et 2 cm3
d’acide
éthanoïque pur. Adapter un réfrigérant à air sur l’erlenmeyer.
- Placer
l’erlenmeyer dans un bain-marie d’eau bouillante
tout en agitant, à l’aide d’une pince en bois, jusqu’à dissolution
complète du
para-aminophénol ( durée 10 à 15 min ).
- La
solution est ensuite ramenée à la température
ambiante en refroidissant l'erlenmeyer à l’air puis dans un bain d'eau
froide.
Oter le réfrigérant à air de l’erlenmeyer.
- Maintenir
l’eau du bain-marie à l’ébullition pour une
prochaine expérience.
2) Questions
« Cette
dissolution se fait, à chaud, avec une
solution d’acide éthanoïque ». Pourquoi à chaud ?
Quel est le rôle de
l’acide éthanoïque ?
La solubilité du
4-aminophénol est
plus importante à chaud qu’à froid.
De plus, l’acide éthanoïque réagit
avec le
groupe amine (basique) ─ NH2 et
de fait, accélère la dissolution.
3.3 Synthèse
du paracétamol
1) Manipulation
- Ajouter
cm3
par cm3 , un volume de 3,5 cm3
d’anhydride
éthanoïque, tout en agitant.
- Placer
l’erlenmeyer dans un cristallisoir d’eau glacée.
Attendre la cristallisation du paracétamol (si celle-ci tarde à se
réaliser, on
peut pour l’initier, gratter le fond du ballon, sans agiter, avec une
tige de
verre).
- Essorer
les cristaux à l’aide de la fiole à vide et du
Büchner, en tirant sous vide à la trompe à eau. Laver avec un peu d’eau
froide.
- Sécher
les cristaux entre deux feuilles de papier
filtre.
- Peser
le paracétamol « brut » obtenu.
2) Questions
Calculer
la quantité de matière des deux réactifs. Y
en a-t-il un en excès ? Si oui, lequel ?
Para aminophénol
= 4-aminophénol :

Anhydride
éthanoïque :
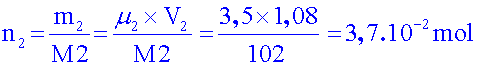
Tous les
coefficients de la réaction sont égaux à 1.
Donc le Para
aminophénol est le réactif limitant.
Quelle
masse de paracétamol peut-on théoriquement obtenir ?

Calculer
le rendement η dans
le cas du paracétamol
brut obtenu précédemment.

Quelle
impureté a-t-on éliminée par
filtration ?
On a éliminé l’acide
éthanoïque ( celui
présent initialement, celui formé lors de la réaction de l’anhydride +
l’eau
et celui formé lors de la synthèse )
3.4
Purification
du paracétamol brut par
recristallisation
1) Manipulation ( schémas p 196 )
- Introduire
le paracétamol brut dans un erlenmeyer de
100 mL. Ajouter 20 à 25 mL d’eau.
- Placer
l’erlenmeyer dans un bain marie maintenu à
ébullition jusqu’à dissolution totale..
- Laisser
refroidir à l’air, puis dans de
l’eau froide et enfin plonger l’erlenmeyer dans un cristallisoir d’eau
glacée.
- Laisser
cristalliser le paracétamol purifié.
- Essorer
à nouveau les cristaux à l’aide de la fiole à
vide et du Büchner, en tirant sous vide à la trompe à eau. Laver avec
un peu
d’eau froide.
- Sécher
les cristaux entre deux feuilles de papier
filtre.
- Peser
le paracétamol « purifié » obtenu.
2) Question
La
technique de purification du paracétamol s’appelle
recristallisation. Sur quelle propriété physique du paracétamol
s’appuie-t-elle ?
La technique de
recristallisation est
fondée sur la différence de solubilité du paracétamol à chaud et à
froid.
De façon générale, pour cette technique,
on choisit un solvant dans lequel le solide est soluble à chaud et peu
soluble
à froid. On ajoute le minimum de solvant.
La recristallisation doit être assez
lente. Elle est amorcée par le choc thermique ou en faisant crisser une
baguette de verre contre la paroi.
Quelle(s)s
impuretés a-ton éliminée(s) ?
L’acide
éthanoïque
restant.
De façon générale, lors d’une
recristallisation, il faut que les impuretés soient solubles à froid
dans le
solvant.
Calculer
le rendement η'
de
la synthèse en
prenant pour produit final le paracétamol purifié. Comparer au résultat
obtenu
précédemment.

On constate que η’
< η
( logique car il
y a eu des pertes…)