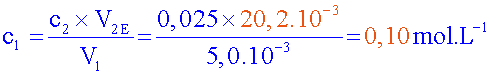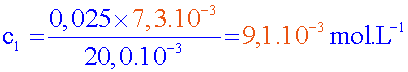Ch
3.1 Dosage des
ions chlorure
d’une eau par la méthode de
Mohr
CE
TP correspond à la séquence 2p 174 du livre
1.Principe:
On dose une solution d’ions chlorure Cl-
de concentration molaire c1 à l’aide d’une
solution d’ions Ag+
de concentration molaire c2 connue, en présence
d’une solution de chromate neutre de potassium servant d’indicateur de
fin de réaction.
2.Expériences
préliminaires
2.1 Expérience
1
Dans
un tube à essais, verser:
- 1 mL
d’une solution incolore de chlorure de
sodium (Na+(aq)
+ Cl-(aq))
à 0,1 mol.L-1
- quelques
gouttes d’une
solution incolore de nitrate d’argent (Ag+(aq)
+ NO3-(aq)).
Qu’observe-t-on ?
On observe un précipité
blanc de chlorure d’argent AgCl
Un
précipité est un solide
peu soluble dans l’eau.
Ecrire l’équation de la réaction.
Ag+(aq)
+ Cl-(aq) = AgCl(s)
2.2 Expérience
2
Dans
un tube à essais, verser 10 mL d’eau distillée, ajouter quelques
gouttes d’une solution jaune de chromate de potassium (2K+(aq)
+ CrO42-(aq)).
Introduire
quelques gouttes de solution de nitrate d’argent.
Qu’observe-t-on
?
On observe un précipité
rouge de chromate d’argent Ag2CrO4
Ecrire l’équation de la réaction
.
2 Ag+(aq)
+ CrO42-(aq)
= Ag2CrO4 (s)
2.3
Expérience
3
Dans
un tube à essais, verser 1 mL de solution de chlorure de sodium,
ajouter quelques gouttes de solution de chromate de potassium. Ajouter
progressivement la solution de nitrate d’argent.
Qu’observe-t-on?
On observe d’abord un
précipité blanc de chlorure d’argent (précipité coloré en jaune dû aux
ions CrO42-) puis
un précipité rouge de chromate d’argent.
Interpréter.
Quand
2 précipités peuvent se former, c’est le moins
soluble dans l’eau qui apparaît en premier : le
chlorure d’argent AgCl
précipite avant le chromate d’argent Ag2CrO4
, donc AgCl
est moins soluble dans l’eau que Ag2CrO4 (c’est le phénomène de précipitation
préférentielle).
3. Dosages
3.1 Principe du dosage
On veut titrer la
concentration en ions chlorure
d’une solution.
On
verse un peu de chromate
neutre de
potassium dans la solution, puis on dose en versant progressivement une
solution titrée de nitrate d’argent.
Faire un schéma du
dispositif employé pour le dosage.

Qu’observera-t-on
initialement ? ( avant l’équivalence ).
avant
l’équivalence,
les ions argent Ag+
(réactif limitant) réagissent avec les ions chlorure Cl- :
au fur et à mesure que l’on verse des ions Ag+,
il se forme du précipité AgCl
blanc.
Que
se passe-t-il après
l’équivalence ?
après
l’équivalence,
il ne reste plus d’ions Cl- en
solution ; les ions argent Ag+
versés en excès réagissent avec les ions chromate CrO42-
: précipité Ag2CrO4 rouge
Quel est l’indicateur
d’équivalence ?
l’apparition
de la
coloration rouge persistante indique la fin du dosage des ions Cl- :
c’est l’équivalence.
On réalise un dosage direct par
précipitation.
Quels
sont les critères auxquels doit
répondre une réaction de précipitation pour qu’elle puisse être
utilisée pour faire un dosage ?
Pour
réaliser un dosage, une réaction doit être unique, totale et rapide.
3.2
Etude théorique
Ecrire l’équation de la réaction de
dosage.
Ag+(aq)
+ Cl-(aq) =
AgCl(s)
Déterminer la relation entre les
concentrations molaires en ions chlorure Cl - (c1)
et en ions Ag+(c2)
et les volumes des solutions d’ions
chlorure Cl - (V1) et
d’ions Ag+
versés à l’équivalence (V2E).
A l’équivalence, n(Ag+)E
= ni(Cl-)
c2 × V2E = c1 × V1
3.3 Mode
opératoire
Remplir
la burette avec la solution de nitrate d’argent.
1) Dosage
d’une eau salée de concentration c1
connue
Verser
5 mL d’eau salée dans un bécher. Ajouter 1 mL de solution de chromate
de potassium.
Doser à l’aide de la solution de nitrate
d’argent. ( faire un
dosage rapide, puis un dosage précis )
Noter le volume de
solution de nitrate d’argent versé à l’équivalence.
En
déduire la concentration expérimentale en ions chlorure Cl -
(c1,exp)
et la comparer à c1.
c
2 =
0,025 mol.L
-1
V
1 = 5 mL
V
2E
=
20,2
mL
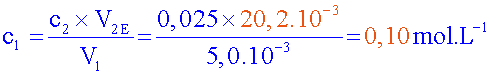
Donc
la concentration correspond à la concentration connue ( c
1
= 0,1
mol.L
-1 )
2) Dosage
de l’eau du robinet :
Verser
100 mL d’eau du robinet dans un erlenmeyer
de 250 mL. Ajouter 2 à 3 mL de solution de chromate de potassium. Doser
avec la solution de nitrate d’argent.
Noter le volume de
solution de nitrate d’argent versé à l’équivalence.
En déduire la
concentration en ions chlorure Cl - de l’eau du
robinet.
c
2
=
0,025 mol.L
-1
V
1 = 100 mL
V
2E =
1,2 mL

3)
Dosage
d’une eau minérale :
Verser
20 mL d’eau de Vichy-Saint-Yorre
dans un bécher. Ajouter 1 mL de solution de chromate de potassium.
Doser à l’aide de la solution de nitrate d’argent.
Noter le
volume de solution de nitrate d’argent versé à l’équivalence.
En
déduire la concentration massique en ions chlorure Cl -
et la comparer à celle indiquée sur l’étiquette de la bouteille.
c
2
=
0,025 mol.L
-1
V
1 = 20 mL
V
2E =
7,3 mL
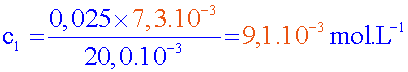
Or
:
M(Cl
-) =
35,5 g.mol
-1
Donc
la concentration massique : 9,1.10
-3 × 35,5 =
3,2 . 10
-1
g.L
-1
sur
l’étiquette, Cl
- :
322 mg.L
-1
La
valeur trouvée par dosage correspond bien à la valeur indiquée par
l'exploitant de l'eau minérale.