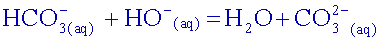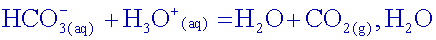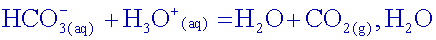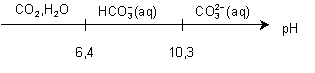3.4
dosage des ions
hydrogénocarbonates dans une eau minérale
On
veut déterminer par titrage acido-basique soit à l’aide d’un pH-mètre,
soit en utilisant un indicateur coloré approprié, la quantité d’ions
hydrogénocarbonate contenus dans une eau de boisson ; comparer
à l’information portée sur l’étiquette.
1.Etude du comportement
de l’ion hydrogénocarbonate
L’ion
hydrogénocarbonate HCO3-est
un ampholyte : il apparaît dans les couples :
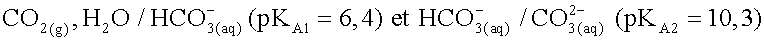
On
veut déterminer la procédure pour titrer une espèce ampholyte (faut-il
la considérer comme un acide ou comme une base ?) en
utilisant les diagrammes de distribution des espèces en solution pour
choisir les conditions du titrage.
1.1
Etude
des réactions
Ecrire les équations
des deux réactions possibles des ions hydrogénocarbonates avec l’eau.
L’ion
hydrogénocarbonate se comporte comme un acide :
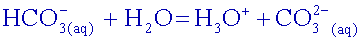
L’ion
hydrogénocarbonate se comporte comme une base :
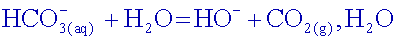
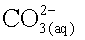 et d'ions hydrogénocarbonate
et d'ions hydrogénocarbonate 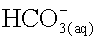 . Montrer,
à partir des
constantes d’équilibre, que l'affirmation suivante est exacte :
“ Une eau dont le pH est supérieur à 8,2 contient des ions
carbonate, une eau dont le pH est inférieur à 8,2 ne contient
pratiquement pas d'ions carbonate. ”
. Montrer,
à partir des
constantes d’équilibre, que l'affirmation suivante est exacte :
“ Une eau dont le pH est supérieur à 8,2 contient des ions
carbonate, une eau dont le pH est inférieur à 8,2 ne contient
pratiquement pas d'ions carbonate. ”

Donc
une eau de pH 8,2 contient environ 100 fois moins d’ions carbonate
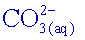
que
d’ions
hydrogénocarbonate
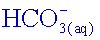
.
( si pH< 8,2
on peut considérer qu’il n’y a pas d’ions carbonate dans l’eau)
1.2
Etude
du diagramme de
distribution

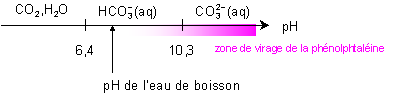
Dans quel domaine
de pH, l’espèce 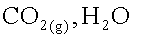 représente-t-elle plus de
99% des espèces de ces couples ?
représente-t-elle plus de
99% des espèces de ces couples ?
pH < 4,5
Même question pour les ions carbonates 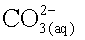 .
.
pH > 12
1.3
Titrage d’une solution d’ions
hydrogénocarbonate par une solution acide ou basique
1)
Une solution d’ions hydrogénocarbonate est
titrée par une solution de soude.
Ecrire
l’équation
de la
réaction entre les ions hydrogénocarbonate et les ions
hydroxyde apportés
par la solution de soude  .
.
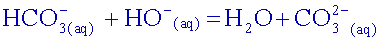
Quel
est l’ordre de
grandeur du pH à l’équivalence du titrage ? Justifier la
réponse.
L’équivalence
est
atteinte lorsque les ions hydrogénocarbonate ont totalement disparu
c’est à dire pour un pH > 12.
2) Une
solution d’ions hydrogénocarbonate est
titrée par de l’acide chlorhydrique
Ecrire
l’équation de la
réaction entre les ions hydrogénocarbonate et les ions oxonium apportés
par l’acide.
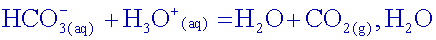
Quel
est l’ordre de
grandeur du pH à l’équivalence de ce titrage ? Justifier la
réponse.
L’équivalence est
atteinte lorsque les ions hydrogénocarbonate ont totalement disparu
c’est à dire pour un pH < 4,5.
1.4
Réalisation pratique
1) Limite des
pH-mètre
Les
pH-mètres du lycée ont des électrodes qui ne donnent pas des
indications fiables pour pH>11.
Pour
lequel des 2 dosages de
l’ion hydrogénocarbonate peuvent-ils servir?
Ils
ne peuvent servir que pour le dosage par l’acide chlorhydrique.
2)
On
donne le tableau des indicateurs colorés
On donne le
tableau des indicateurs colorés
| Indicateur |
Couleur |
Zone de virage |
Largeur de la zone de virage |
| Forme acide |
Forme basique |
| Bleu de bromophénol |
Jaune |
Bleu |
3,1 - 4,5 |
2,4 |
| Hélianthine (ou méthyl-orange) |
Rouge |
Jaune |
3,2 - 4,4 |
1,2 |
| Vert de bromocrésol rhodamine |
Jaune-rosé |
Bleu |
3,8
- 5,4 |
1,6 |
| Bleu de bromothymol |
Jaune |
Bleu |
6,0 - 7,6 |
1,6 |
| Rouge de méthyle |
Jaune |
Rouge |
4,8 - 6,0 |
1,2 |
| Phénolphtaléine |
Incolore |
Rose |
8,2 - 10,0 |
1,8 |
Pour
lequel des 2 dosages
de
l’ion hydrogénocarbonate peuvent-ils servir?
Aucun
indicateur ne peut mettre en évidence l’équivalence lors du dosage par
la soude
( pH >>12)
A
l’aide des résultats
de l’approche théorique et des données du tableau des zones de virage
de quelques indicateurs colorés, justifier le choix du vert de
bromocrésol rhodamine (BCR) comme indicateur coloré dans ce titrage.
L’ordre
de grandeur du pH à l’équivalence du titrage des ions
hydrogénocarbonate par les ions oxonium (pH 4,5) se situe dans la zone
de virage du vert de bromocrésol rhodamine.
3 )Choix de la verrerie
Quelle
verrerie peut-on utiliser pour mesurer
les 50,0 mL d’eau minérale :
fiole
jaugée de 50 mL
et le volume
d’acide
ajouté lors du dosage ?
burette
graduée
2. courbe
pH-métrique
2.1 Manipulation
Etalonner
le pH-mètre.
Prélever
50,0 mL d’eau de
boisson. Les verser dans un bécher. Ajouter quelques gouttes de BCR.
Doser
avec une solution d’acide
chlorhydrique à 0.02 mol.L-1.
Tracer
la courbe pH = f(
volume d’acide chlorhydrique versé. ( verser l’acide mL par mL puis,
resserrer les mesures lorsque les variations de pH augmentent ).
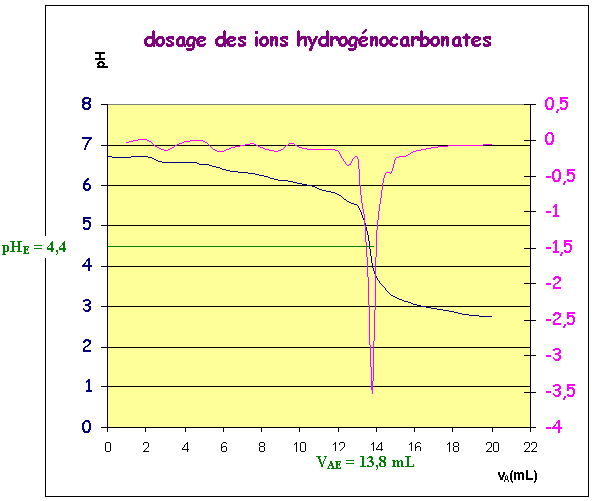
Courbe obtenue avec de l'eau d'Evian
2.2 Détermination de la
concentration en ions hydrogénocarbonate
Quelle
est la
valeur du volume VaE d’acide
versé à l’équivalence ?
VAE
= 13.8
mL ( pour l'eau d'Evian )
Quelle est la valeur du
pH
à
l’équivalence ? Est-elle conforme aux prévisions?
pH
= 4,4
( prévision : 4,5 )
Calculer
la concentration
molaire des ions hydrogénocarbonate dans l’eau étudiée.
Equation
bilan du dosage :
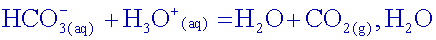
A
l’équivalence,

En
déduire la masse d’ions
hydrogénocarbonate contenus dans 1,0 L
de cette eau.
Dans 1 L,
il y a 5,52.10-3
mol,
soit m = n× M = 5,52.10-3 × ( 1+ 12+
3×16) = 0,337 g = 337 mg
Comparer
à l’information donnée par l’étiquette de la
bouteille.
Sur
l’étiquette, on
précise une concentration massique :
Eau d'Evian: 357 mg/L
Eau de Contrex : 372 mg/L
Si on estime que
l’indication de
l’étiquette est valable à 10 % près, les résultats trouvés sont-ils en
accord avec la valeur portée sur l’étiquette ?
357-36 <t< 357+36
ou : 321 < t< 393
La
valeur trouvée (337
) est bien dans cet
intervalle.
3.
Compléments
3.1 Différentes eaux
Qu’entend-on
par « eau de boisson » ?
Une eau de boisson est
une eau potable, c’est à dire qui satisfait aux 62
critères de potabilité définis par le Code de Santé Publique français
Quelle
différence existe-t-il entre une « eau minérale » et
une « eau de source » ?
Une
« eau de source » est issue des
eaux souterraines . Elle est naturellement propre à la consommation.
Les seuls traitements qu’il est permis de lui appliquer sont
l’aération, la décantation et la filtration.
Une
« eau minérale » est une eau de
source ayant des propriétés particulières. Elle est recommandée par
l’Académie de Médecine ; elle peut être considérée comme un
« médicament » et contre-indiquée dans certaines
affections (par exemple, les eaux très minéralisées sont
contre-indiquées aux personnes ayant des calculs rénaux et les eaux
très salées aux personnes soumises à un régime sans sel).
Une eau
minérale ne satisfait pas toujours aux critères de potabilité.
3.2 Titres alcalimétriques
Dans
les activités se rapportant au traitement des eaux, on utilise des
échelles spécifiques pour exprimer les concentrations en ions carbonate
et en ions hydrogénocarbonate, les “titres
alcalimétriques” :
1) Titre alcalimétrique (noté T.A.)
«c’est
le volume d'acide, de concentration molaire en ions H3O+
égale à 0,02 mol.L-1, nécessaire pour doser 100
mL d’eau en présence de phénolphtaléine»
A partir des
diagrammes
de distribution, établir les domaines de prédominances, en fonction du
pH, des espèces chimiques des couples acide-base mis en jeu.
A
partir des domaines
de prédominance et de la zone de virage de la phénolphtaléine, indiquer
quels sont les ions titrés lors de la détermination du titre
alcalimétrique.
Déterminer
le T.A.
Pour
l’eau d’Evian, le pH = 7
; la phénolphtaléïne reste
incolore. T.A = 0
Vérifier
expérimentalement.
2) Titre alcalimétrique complet (T.A.C.)
«c’est
le volume d'acide, de
concentration molaire en ions H3O+
égale à 0,02 mol.L-1, nécessaire pour doser 100
mL d’eau en présence de vert
de bromocrésol rhodamine (BCR)»
Déterminer le
T.A.C. de l’eau étudiée à partir des observations et des résultats
expérimentaux.
VAE
= 13.8
mL (
pour 50 mL)
Donc T.A.C. = 13,8 × 2 = 27,6
Sur l'étiquette : T.A.C.
= ?????
Remarque : l'ion "hydrogénocarbonate" est communément appélé ion
"bicarbonate"....
Compléments : L'Ardèche est le pays de l'eau....
Composition de l'eau
minérale de Vals :
|
Composition en mg/l
|
|
calcium = 45,2
|
magnésium = 21,2
|
sodium = 453
|
|
sulfate = 38,9
|
chlorure = 27,2
|
potassium = 32,8
|
|
nitrate = < 1
|
bicarbonate = 1403
|
ph = 6,2
|
Composition de l'eau minérale du Vernet
( captée à Prades)
|
Composition en mg/l
|
|
calcium = 33,5
|
magnésium = 17,6
|
sodium = 192
|
potassium = 28,7
|
|
fluor = 1,3
|
bicarbonate = 734
|
sulfate = 14
|
chlorure = 6,4
|
|
nitrate = < 1
|
nitrite = < 0,01
|
phosphate = < 0,05
|
résidu sec = 675
|
Composition de l'eau minérale de Ventadour
( captée à Meyras)
Eau décantée , filtrée et renforcée au gaz de la
Source " Source du Pestrin "
|
Composition en mg/l
|
|
calcium = 43,5
|
magnésium = 11,5
|
sodium = 15,5
|
|
sulfate = 4,8
|
chlorure = 3
|
potassium = 1,8
|
|
bicarbonate = 244
|
nitrate = 0,05
|
silice = 45,7
|
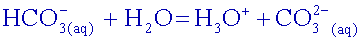
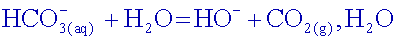
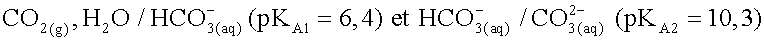
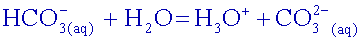
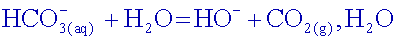
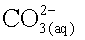 et d'ions hydrogénocarbonate
et d'ions hydrogénocarbonate 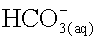 . Montrer,
à partir des
constantes d’équilibre, que l'affirmation suivante est exacte :
“ Une eau dont le pH est supérieur à 8,2 contient des ions
carbonate, une eau dont le pH est inférieur à 8,2 ne contient
pratiquement pas d'ions carbonate. ”
. Montrer,
à partir des
constantes d’équilibre, que l'affirmation suivante est exacte :
“ Une eau dont le pH est supérieur à 8,2 contient des ions
carbonate, une eau dont le pH est inférieur à 8,2 ne contient
pratiquement pas d'ions carbonate. ”

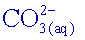 que
d’ions
hydrogénocarbonate
que
d’ions
hydrogénocarbonate 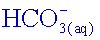 .
( si pH< 8,2
on peut considérer qu’il n’y a pas d’ions carbonate dans l’eau)
.
( si pH< 8,2
on peut considérer qu’il n’y a pas d’ions carbonate dans l’eau)
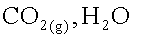 représente-t-elle plus de
99% des espèces de ces couples ?
représente-t-elle plus de
99% des espèces de ces couples ? 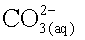 .
.
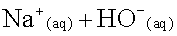 .
.