Ch 4.1 Séparation des
ions Fer III et des ions cuivre II
Les minerais de cuivre sont
principalement constitués de sulfures ou d’oxydes, contenant moins de 2
% de
cuivre et d’autres éléments
métalliques (fer, nickel, …) considérés comme des
impuretés.
Le cuivre peut être extrait de
son minerai par hydrométallurgie où le minerai est attaqué par une
solution
aqueuse acide.
La mise en solution aqueuse va
permettre d’éliminer certains ions métalliques par précipitation.
Dans ce Tp, on va réaliser la séparation
des ions fer III des ions cuivre II par la technique de précipitation.
1.Introduction
En solution, les ions métalliques
précipitent en présence d’ions hydroxyde (HO-(aq))
donnant des hydroxydes métalliques.
1.1
Avec
les ions Fe3+
Introduire
dans un tube à essais 2 mL de solution de
chlorure de fer III (Fe3+(aq)
+ 3 Cl-(aq) ).
Ajouter
quelques gouttes de solution d’hydroxyde de
sodium (Na+(aq) + HO-(aq)).
Noter
vos observations. Ecrire l’équation qui traduit
la réaction.
En présence d’ions
hydroxyde, les ions fer III précipitent
en donnant un précipité rouille d’hydroxyde de fer III
Fe 3+(aq)
+
3 HO-(aq)
= Fe(OH)3 (s)
K1
= 1,0.1038
Réaction totale!
1.2
Avec
les ions Cu2+
Même manipulation avec une solution de
sulfate de cuivre II (Cu2+(aq)
+ SO42-(aq)).
Noter
vos observations. Ecrire l’équation qui traduit
la réaction.
En présence
d’ions hydroxyde, les ions cuivre II précipitent
en donnant un précipité bleu d’hydroxyde de cuivre II
Cu 2+(aq) + 2
HO-(aq)
=
Cu(OH)2 (s)
K2 = 1,7.1019
Réaction totale!
2.
Principe
de la méthode de séparation des ions métalliques
La
précipitation des hydroxydes
métalliques dépend fortement du pH. On se propose de le vérifier pour
des
solutions de concentrations C, identiques, en ions métalliques.
2.1
Précipitation
des ions fer III
1) Manipulation
Introduire
dans un bécher 10,0 mL de solution de chlorure
de fer III à 0,2 mol.L-1 et ajouter 10 mL d’eau
distillée ( pas plus! on dilue donc 2 fois ).
Mesurer le pH initial.
Verser ensuite un
volume Vb de solution
d’hydroxyde de sodium de 0,5 en 0,5 mL et noter le pH correspondant
jusqu’à la
fin du saut de pH.
Tracer,
sur papier millimétré, la courbe pH = f(Vb).

Noter
le pH de début de précipitation.
La précipitation est
immédiate
( v <
0.5 mL et pH ~2 )
Noter
le pH de début de saut et le pH de fin de
saut..
Le pH de début de saut
est

3
Le pH de fin de saut est

12
2) Questions
Exprimer
le
quotient de réaction Qr1
La
précipitation commence lorsque Qr1 = K1,
calculer le pHthéorique
de début
de précipitation ( la
concentration des composés ioniques dissous étant égale à 0,1 mol.L-1 car la solution initiale a été diluée 2 fois...).
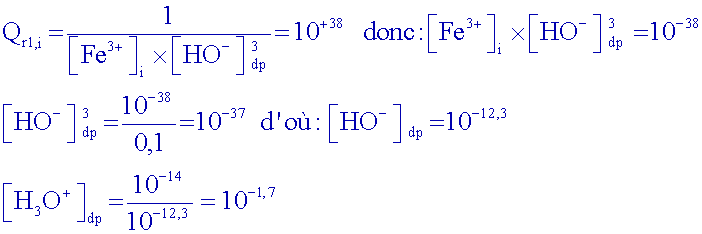
d’où
le pH de
début de précipitation : pHdp = 1,7
Comparer avec la valeur
expérimentale
trouvée.
La précipitation
expérimentale démarre à pH

2 .
Connaissant
le pH
du début
de saut, calculer la concentration restante d’ions fer
III
dans la solution à ce moment.
Début
de
saut : pH

3 .
Donc, à ce moment
là : [ H
3O
+] ~
10
-3 mol.L
-1
et [HO
-] ~
10
-11
mol.L
-1
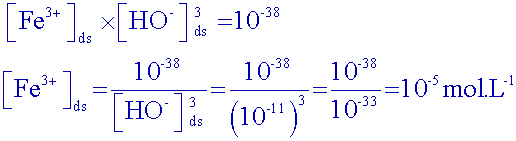
Peut-on
affirmer que tous les ions ont
précipité ?
La concentration
des ions fer III a été divisée par 104 . On peut
considérer qu’ils
ont tous réagi….
Expliquer
le saut brutal de pH..
Au début les ions HO-
versés
réagissent avec les ions Fe3+ et forment le
précipité d’hydroxyde de
fer.
Quand tous les ions fer III ont précipité, les ions
hydroxyde ajoutés ne réagissent plus et le pH augmente rapidement.
2.2
Précipitation
des ions cuivre II
1) Manipulation
Introduire
dans un bécher 10 mL de solution de sulfate de cuivre II à 0,2
mol.L-1. et ajouter 10 mL d’eau
distillée .
Mesurer le pH initial.
Verser ensuite un
volume Vb de solution
d’hydroxyde de sodium de 0,5 en 0,5 mL et noter le pH correspondant
jusqu’à la
fin du saut de pH.
Tracer,
sur papier millimétré, la courbe pH = f(Vb).
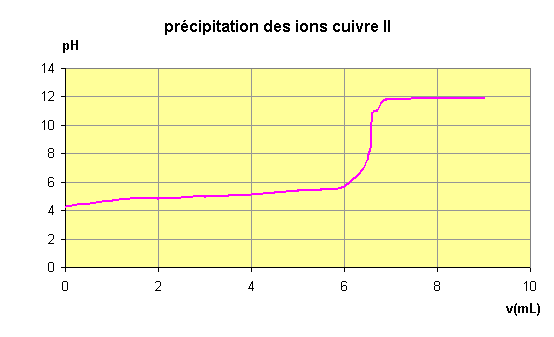
Noter
le pH de début de précipitation.
La précipitation n’est pas
immédiate ( v

4 mL et
pH

4,5 )
Noter
le pH de début de saut et le pH de fin de
saut..
Le pH de début de saut
est

6
Le pH de fin de saut est

12
2)
Questions
Exprimer
le
quotient de réaction Qr2
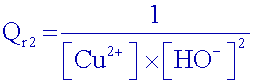
La
précipitation commence lorsque Qr2 = K2,
calculer le pHthéorique
de début
de précipitation ( la
concentration des composés ioniques dissous étant égale à 0,1 mol.L-1).
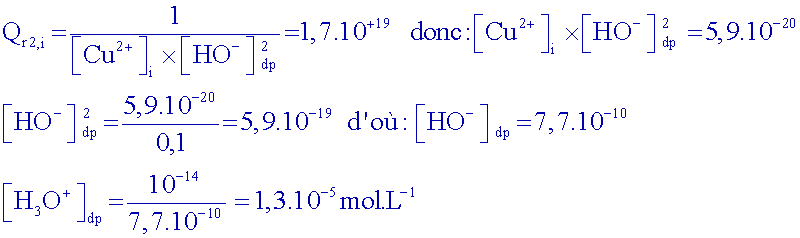
d’où
le pH de
début de précipitation : pH = 4,9
Comparer avec la valeur
expérimentale
trouvée.
La précipitation
expérimentale démarre à pH

4.5 donc
les
valeurs sont voisines.
Connaissant
le pH
du début
de saut, calculer la concentration restante d’ions cuivre
II
dans la solution à ce moment.
Début
de
saut : pH

6
Donc, à ce moment
là : [ H
3O
+]

10
-6 mol.L
-1
et [HO
-]

10
-8 mol.L
-1
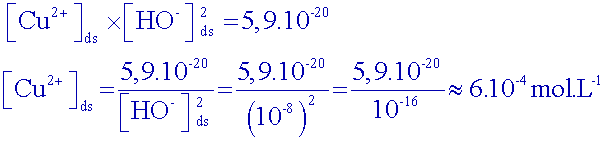
Peut-on
affirmer que tous les ions ont
précipité ?
La concentration
des ions cuivre est passée de 1,0.10-1 à 6.10-4 mol.L-1
. On peut considérer qu’ils ont tous réagi….
Expliquer
le saut brutal de pH..
Au début les ions HO-
versés
réagissent avec les ions Cu2+ et forment le
précipité d’hydroxyde de
cuivre.
Quand tous les ions Cu2+
ont précipité, les
ions hydroxyde ajoutés ne réagissent plus et le pH augmente
rapidement.
2.3
Conclusion
Quels
sont les domaines de précipitation de chaque
ion ?
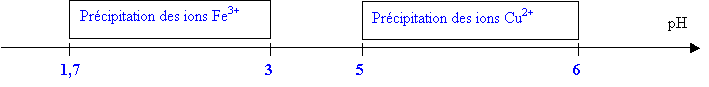
les 2 domaine de précipitation sont
disjoints
Proposer
une méthode permettant de séparer les ions
Cu2+ et Fe3+ dans un
mélange.
On versera une quantité
d’ions hydroxyde telle que pH

3,5
Tous les ions Fe
3+ auront alors
précipité.
A ce moment, il suffit de filtrer afin de récupérer les
ions cuivre II en solution aqueuse
3.
Séparation
des ions Cu2+ et des ions Fe3+
dans un mélange
3.1
Manipulation
Reprendre
le montage précédent.
Introduire
dans le bécher 10 mL de solution de chlorure
de fer III à 0,2 mol.L-1 et 10 mL de solution de sulfate de cuivre
II à 0,2 mol.L-1.
Mesurer
le pH initial.
Verser
ensuite l’hydroxyde de sodium à 0,5 mol.L-1
jusqu’à ce que le pH atteigne une
valeur entre le pH de fin de précipitation des ions fer III et le pH de
début de précipitation des ions cuivre II.
Filtrer
alors le mélange contenu dans le bécher.
3.2
Conclusion
Quelle
est l’espèce éliminée de la solution ?
Sous quelle forme est-elle obtenue ?
On a éliminé les
ions Fe3+ de la solution ; ils ont dans
le précipité
d’hydroxyde de fer III rouille
Quelle
est la couleur du filtrat ? bleu clair
Quelle
est l’espèce chimique contenue dans le
filtrat ? les ions cuivre II : Cu2+(aq)
Comment
vérifier qu’il ne contient qu’un type
d'ions ?
par ajout de soude, on obtient un
précipité bleu
d’hydroxyde de
cuivre II: Cu(OH)2(s)
L’objectif
est-il atteint ? Conclure.
L’objectif est
atteint : il est
possible, par variation de la concentration [HO-],
donc du pH, de
faire précipiter la quasi-totalité de l’élément fer sous forme
d’hydroxyde de
fer III tout en conservant les ions cuivre II en
solution :on a
réalisé une précipitation fractionnée.
 3
Le pH de fin de saut est
3
Le pH de fin de saut est  12
12

 3
Le pH de fin de saut est
3
Le pH de fin de saut est  12
12
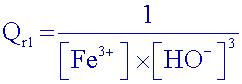
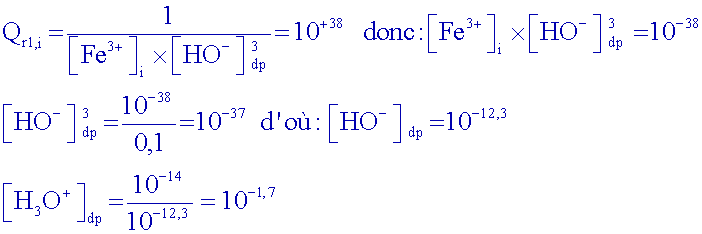
 2 .
2 .
 3 .
3 . 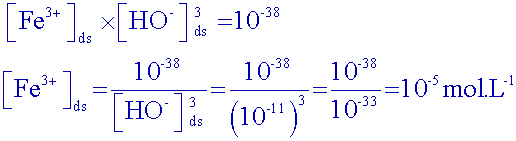

 4 mL et
pH
4 mL et
pH  4,5 )
4,5 )
 6
Le pH de fin de saut est
6
Le pH de fin de saut est  12
12
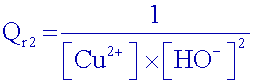
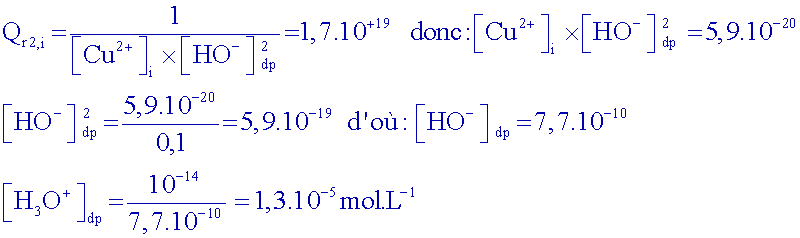
 4.5 donc
les
valeurs sont voisines.
4.5 donc
les
valeurs sont voisines.
 6
6
 10-6 mol.L-1
et [HO-]
10-6 mol.L-1
et [HO-]  10-8 mol.L-1
10-8 mol.L-1
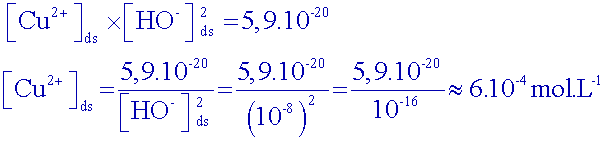

 3,5
3,5